
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸
点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。
某学生拟用左下图所示装置模拟工业制取并收集ClO2。
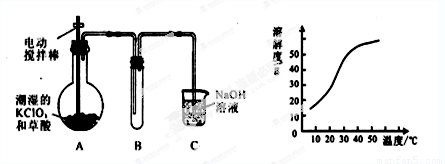
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有 、 ;
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中
ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1mL试样加入到锥
形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;此时发生的离子方程式
为: ;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
则原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
(1)2KClO3+H2C2O4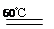 2ClO2↑+CO2↑+K2CO3+H2O
2ClO2↑+CO2↑+K2CO3+H2O
(2)烧杯、温度计
(3)蒸发浓缩,冷却至38℃结晶 趁热过滤
(4)2ClO2+8H++10I-=2Cl- +5I2+4H2O c(ClO2)=135cv2/v1
【解析】
试题分析:(1)根据反应物和产物书写,注意条件,2KClO3+H2C2O4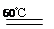 2ClO2↑+CO2↑+K2CO3+H2O
2ClO2↑+CO2↑+K2CO3+H2O
(2)控制温度应采用水浴加热,需用的烧杯和温度计;(3)溶液中根据反应判断溶液中还应有NaClO3,NaClO2溶解度随温度变化较大,且结晶出NaClO2需高于38℃,故结晶应先对溶液蒸发浓缩,冷却到38℃以上结晶,趁热过滤,防止生成结晶水合物;
(4)2ClO2+8H++10I-=2Cl- +5I2+4H2O,根据方程式找关系计算,c(ClO2)=135cv2/v1
考点:考查化学实验有关问题。


科目:高中化学 来源: 题型:
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.| 50a |
| 13 |
| 50a |
| 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
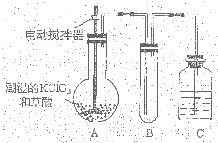 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com