一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)

Ni(CO)
4(g) 该反应的△H
<
<
0(选填“>”或“=”或“<”).
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O
2(g)=CO
2(g);△H
1=-393.5kJ?mol
-1CO
2(g)+C(s)=2CO(g);△H
2=+172.5kJ?mol
-1S(s)+O
2(g)=SO
2(g);△H
3=-296.0kJ?mol
-1请写出CO除SO
2的热化学方程式
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
.
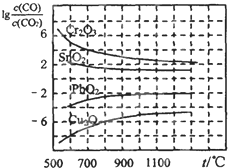
(3)金属氧化物被一氧化碳还原生成金属单质和二氧化碳如图1是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO
2)]与温度(t)的关系曲线图.则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=
.800℃时,其中最易被还原的金属氧化物是
Cu2O
Cu2O
(填化学式),该反应的平衡常数数值(K)等于
106
106
.
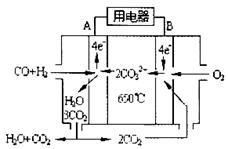
(4)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H
2)为燃料,一定比例Li
2CO
3和Na
2CO
3低熔混合物为电解质.写出B极发生的电极反应式
2CO2+O2+4e-=2CO32-
2CO2+O2+4e-=2CO32-
.


 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;

 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料. Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H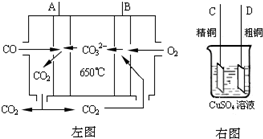

 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。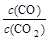 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。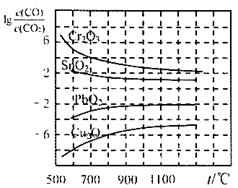
 CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1 CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1 CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。