
现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.336 g。
(1)试通过计算确定M2CO3的M为何种元素。
(2)有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?
(1)(3分)
2NaHCO3~ Na2CO3 ~ CO2~ CaCO3
n(NaHCO3)= × 2=0.016mol
× 2=0.016mol
2CO2+2Na2O2=2Na2CO3+O2 △m
2mol 56g
(0.012mol) 0.336g
加热后的n(M2CO3)=0.012mol-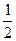 ×0.016mol =0.004mol 设M的相对原子质量分别x。
×0.016mol =0.004mol 设M的相对原子质量分别x。
依题意:84g·mol-1×0.016mol+(2x+60)g·mol-1×0.004mol=1.896g x=39
根据碱金属的相对原子质量,可知M元素是K。
(2)对混合物进行焰色反应实验,透过蓝色的钴玻璃,若看到浅紫色火焰,则说明M元素是K。(2分)
解析


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)混合物中酸式碳酸盐有________________mol。(不写计算过程)
(2)加热灼烧后残留的固体含碳酸盐_______________mol。(不写计算过程)
(3)通过计算,确定这两种盐的化学式,写出计算和推理过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)混合物中酸式碳酸盐物质的量为__________ mol。
(2)加热后残留固体中两碳酸盐物质的量之和为__________ mol。
(3)通过计算和推理确定混合物中两种盐的化学式分别为____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取其1.012 g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.400 g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.168 g。通过计算确定这两种盐的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506 g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200 g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084 g。问:
(1)混合物中酸式碳酸盐有________________mol。(不写计算过程)
(2)加热灼烧后残留的固体含碳酸盐_______________mol。(不写计算过程)
(3)通过计算,确定这两种盐的化学式,写出计算和推理过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com