
下列说法不正确的是(NA表示阿佛加德罗常数):
A.常温常压下,11.2升氯气含有的分子数为0.5NA
B.在常温常压下,1mol氮气含有的原子数为2NA
C.53g碳酸钠中含NA个Na+
D.标准状况下,以任意比例混和的氢气和氧气混和物22.4升,所含的原子数为2NA
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:填空题
(16分)Heck反应是偶联反应的一种,例如:
反应①:
化合物Ⅰ可以由以下途径合成:

(1)化合物Ⅱ的分子式为 ,1mol该物质最多可与 molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程
为 (注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为 。
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚,则其加聚产物的结构简式为 。
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为 。
(6)一定条件下,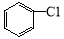 与
与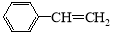 也可以发生类似反应①的反应,其有机产物的结构简式为 。
也可以发生类似反应①的反应,其有机产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是( )
| 操 作 | 现 象 | 结 论 |
A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性: |
B | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有 |
C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 |
D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A.HI和HClO B.HCl和HIO
C.HClO3和HIO D.HClO和HIO
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
下列情况下,气体分子数相同的是
A.标准状况下,71gCl2和22.4LHCl B.相同质量的氢气和氮气
C.在0℃时,1体积的O2和1体积的HCl D.相同体积的CO2和 H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:填空题
海水中溴常以NaBr形式存在,经分析海水中含溴0.07%,则海水中含NaBr的质量分数为 _________。从海水中提取溴的方法之一是:
通入Cl2至浓缩的溴化物溶液,然后用空气把生成的溴吹出。
用Na2CO3溶液吸收溴(其中有5/6的溴的物质的量转化为Br-),同时放出CO2。
向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。
得到的溴中可能夹杂少量有Cl2,再加入少量FeBr2除去
第一步反应的离子方程式 ____________________________________
第四步反应的离子方程式是 _________________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:简答题
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
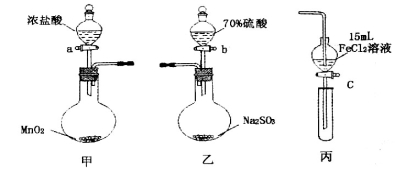
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
A. 通入CO2,溶液pH减小
B.加入NaOH固体, 增大
增大
C.由水电离的c(OH-) = 1×10-10 mol.L-1
D.溶液中:c(CO32-)>c(OH-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
锗(Ge)是第四周期第IVA族元素,处于元素周期表中金属区与非金属区的交界线处,下列叙述正确的是( )
A.锗是一种金属性很强的元素 B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com