
| A、CH3COO-+H2O?CH3COOH+OH- |
| B、NH4++H2O?NH4OH+H+ |
| C、Fe3++H2O?Fe(OH)3+H+ |
| D、Al3++3HCO3-═Al(OH)3↓+3CO2↑ |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| A、加热,观察是否有气体放出 |
| B、溶于水后加BaC12,看有无沉淀 |
| C、溶于水后加石灰水,看有无沉淀 |
| D、取固体变色试样加盐酸,看是否有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa固体 |
| B、NaOH溶液 |
| C、(NH4)2SO4粉末 |
| D、K2SO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯原子的结构示意图: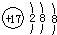 | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: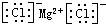 | ||
| D、乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3×6.02×1023 |
| B、1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023 |
| C、常温常压下,16g14CH4所含中子数为8×6.02×1023 |
| D、1molCl2发生反应时,转移的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体 总浓度/ mol?L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.| 盐酸 |
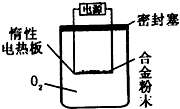
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com