
| A. | 因为都是多糖,所以都具有甜味 | |
| B. | 因为具有相同的分子式(C6H10O5)n,所以互为同分异构体 | |
| C. | 两者都能水解生成葡萄糖 | |
| D. | 淀粉不是天然高分子化合物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCH4中含有氢原子数目为4NA | |
| B. | 1 molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1 mol/LCu(NO3)2溶液中含有的离子数目为0.2NA | |
| D. | 28 gN2中所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
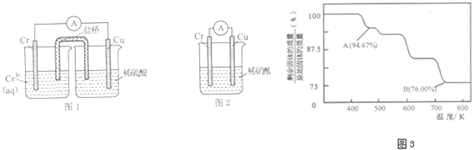
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

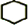 ,名称是环己烷
,名称是环己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性HX>H2Y>ZH3 | B. | 离子半径按X、Y、Z顺序递减 | ||
| C. | 得电子能力 X>Y>Z | D. | 气态氢化物还原性HX<H2Y<ZH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 150 mL 3 mol•L-1KCl溶液 | ||
| C. | 75 mL 1.5 mol•L-1FeCl3溶液 | D. | 50 mL 3 mol•L-1MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| B. | 在标准状况下,22.4L空气中含有NA个单质分子 | |
| C. | 在18g18O2中含有NA个氧原子 | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ③④⑤⑥ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com