
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。
(2)在上图中标明电子转移的方向和数目。
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。
a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁
(4)若向含1mol H5IO6 的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。
(本题共8分)(1)—(2)(共3分,物质1分、配平1分、方向数目1分)
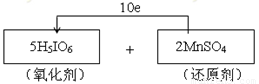
(3)b(1分);
(4)2H5IO6 + 7H2O2 → I2 + 12H2O + 7O2↑(2分),78.4L(2分)
【解析】
试题分析:(1)—(2)高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,这说明反应中有高锰酸钾生成,因此高碘酸是氧化剂,硫酸锰是还原剂。其中I元素的化合价从+7价降低到+5价,得到2个电子。Mn元素的化合价从+2价升高到+7价,失去5个电子,所以根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是5:2,因此电子转移的方向和数目为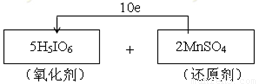 。
。
(3)由于氯气、单质溴以及铁离子的氧化性均强于单质碘的,所以选项acd不可能将高碘酸还原为碘离子。单质碘的氧化性强于S的,因此H2S可以把高碘酸还原为碘离子,答案选b。
(4)向含1mol H5IO6 的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,这说明有单质碘生成。同时有大量气体产生,该气体应该是氧气,所以反应的化学方程式为2H5IO6 + 7H2O2 → I2 + 12H2O + 7O2↑。其中氧气的物质的量是3.5mol,在标准状况下的体积是3.5mol×22.4L/mol=78.4L。
考点:考查氧化还原反应的判断、配平、应用以及有关计算等


科目:高中化学 来源:重庆南开中学高2008级高三月考(5月)理科综合能力测试试卷(化学部分) 题型:022
(1)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.0l mol/L的碘酸(HIO3)或高锰酸(HMnO4溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性.请回答:
①高碘酸是______(填“强酸”或“弱酸”,以下同),高锰酸是________
②已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,反应的离子方程式为_______________________________________________.
(2)在恒温恒容的密闭容器中通入l mol N2和X mol H2发生如下反应;![]() .
.
达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%.
①起始时充入H2物质的量为________mol;
②该反应的热化学方程式为________;
③若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同.
若维持反应向正方向进行,则起始时c的取值范围是________
若c=2 mol,在相同条件下达到平衡时,该反应吸收的热量为________kJ
查看答案和解析>>
科目:高中化学 来源:上海市虹口区2013年高考一模化学试题 题型:043
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程∶H5IO6→HIO3.完成下列填空∶
1.将该反应的氧化剂、还原剂及配平后的系数填入正确位置.

2.在上图中标明电子转移的方向和数目.
3.若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是________(选填序号).
a.盐酸
b.硫化氢
c.溴化钠
d.硫酸亚铁
4.若向含1 mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生.请写出此反应的化学方程式∶________,此过程中至少可得到气体________L(标准状态下).
查看答案和解析>>
科目:高中化学 来源:2013届山东临清三中高二上学期学分认定测试化学试卷 题型:填空题
(6分)(1)某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-) = ____ mol·L-1;若温度不变,滴入稀硫酸使c(H+) = 5.0×10-3 mol·L-1,则c(OH-) = ____ mol·L-1。
(2)已知室温下pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性,则高碘酸的电离方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
【实验方案】
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:

请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有___________________________。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为__________________________________________________;
反应的离子方程式为 、 、_______________________。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com