
下列关于沉淀溶解平衡的说法中不正确的是( )
A.难溶电解质在溶液中存在沉淀溶解平衡,且是一种动态平衡
B.Ksp只与难溶电解质的性质与温度有关,而与沉淀的量和溶液中离子的浓度无关
C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的大小比较电解质在水中溶解能力的大小
D.可通过Q和Ksp的相对大小,来判断沉淀溶解平衡的移动方向
科目:高中化学 来源:2015-2016学年安徽省、泥河中学高二上12月联考化学试卷(解析版) 题型:选择题
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
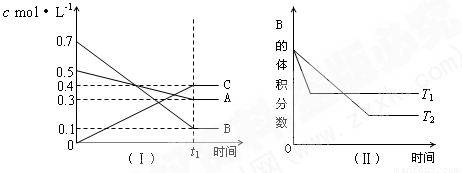
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第三次月考化学试卷(解析版) 题型:选择题
含溶质24g 的3mol/LNaOH溶液,现欲配制成1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为
A.1∶2 B.1∶3 C.2∶1 D.2∶3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
废电池造成污染的问题日益受到关注。集中处理废电池的首要目的是( )
A.回收石墨电极
B.利用电池外壳的金属材料
C.防止电池中渗泄的电解液腐蚀其他物品
D.防止电池中汞.镉和铅等重金属离子对土壤和水源的污染
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式中,错误的是
A.铜丝与硝酸银溶液反应:Cu + Ag+ = Cu2+ + Ag
B.氧化铝与稀盐酸混合:Al2O3 + 6H+ = 2Al3+ + 3H2O
C.稀盐酸与氢氧化钠溶液混合:H+ + OH— = H2O
D.钠与水反应:2Na+ 2H2O = 2Na+ +2OH— + H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期第二次月考化学试卷(解析版) 题型:选择题
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、 K+、 H+、 Cl-、 CO32-、OH- 六种离子中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.Cl-、CO32-、OH- C.K+、H+、 Cl- D.K+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省、高安二中高二上期中联考化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+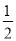 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
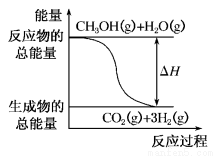
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+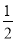 O2(g)===CO2(g)+2H2(g) ΔH >-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期12月月考化学试卷(解析版) 题型:选择题
当光束通过下列分散系时,能产生丁达尔效应的是( )
A.蔗糖水 B.食盐水 C.豆浆 D.小苏打水
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)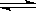 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
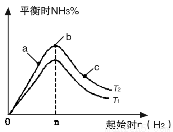
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
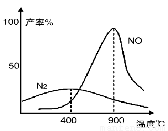
4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)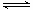 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com