
【题目】下列分子中,电子总数最少的是( )
A. H2S B. O2 C. CO D. NO
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
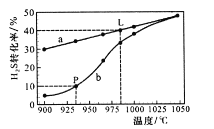
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素 R、X、Y、Z、E的原子序数依次增加,它们的结构和部分信息如下表所示:
元素代号 | 部分信息 |
R | 基态R原子核外有三个能级,每个能级上电子数相同 |
X | X的双原子单质δ键和π键数目之比为1∶2 |
Y | 短周期主族元素中,原子半径最大 |
Z | Z的最高正化合价与最低负化合价之和等于4 |
E | 基态E3+的外围电子排布式是3d5 |
回答问题:
(1)E元素在周期表中的位置是________,其基态原子中电子占据的最高能层是__________________。
(2)元素 X的氢化物M,分子内含18个电子,M的结构式为_____,每个中心原子的价层电子对数是_________________。
(3)在R、X、Z的含氧酸根离子中,互为等电子体的离子组是_________________。
(4)Z元素的两种氧化物对应的水化物中,酸性较强的________,其原因是_________________。
(5)(ZX)4在常压下,高于130℃时(ZX)4分解为相应的单质,这一变化破坏的作用力是________________;它为热色性固体,具有色温效应,低于-30℃时为淡黄色,高于100℃时为深红色.
在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_________________。
(6)常温条件下,E的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为__________,若E原子的半径为r,则单质E的原子空间利用率为________________。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
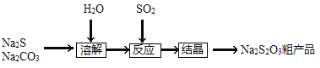
【题目】硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:
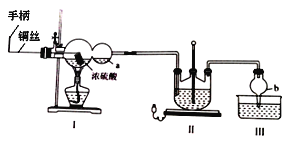
某化学兴趣小组同学模拟该流程设计了如下实验装置:
回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是______(填字母)
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是___________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是____________________________________;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,原黑色物质的组成为____________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________________________________________。
(4)丁同学提出上述实验装置的设计存在不足,建议在I上_____________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
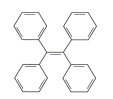
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com