
| A. | 所有原子不在同一平面 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 燃烧时有浓烟 | |
| D. | 与足量溴水反应时,生成物中只有2个碳原子上有溴原子 |
分析 A.根据1-丁炔和1,3-丁二烯平面结构进行分析;
B.二者都是不饱和烃,都能够使高锰酸钾溶液褪色;
C.有机物含碳量较高,燃烧会产生浓烟,而二者含碳量相同;
D.根据炔烃和二烯烃中含有不饱和碳原子个数分析.
解答 解:A.1,3-丁二烯的所有原子都在同一平面上,但1-丁炔分子中3,4碳原子上的氢原子不在同一平面上,故A正确;
B.两者都为不饱和烃,均能使KMnO4溶液褪色,也不能确定,故B错误;
C.丁炔和丁二烯含碳量相同,燃烧都有浓烟,不能据此确定结构,故C错误;
D.与足量溴水反应,生成物中只有2个碳原子上有溴原子,说明是炔烃,因为溴加成后Br原子只能连在炔烃的两个不饱和碳原子上,而1,3丁二烯会出现在四个碳原子上,故D正确.
故选AD.
点评 本题考查了有机物的结构和性质,为高频考点,题目难度不大,根据炔烃和二烯烃的结构决定化学性质、反应产物分析,试题旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.


科目:高中化学 来源: 题型:解答题
| 配料 | 水、果汁、白砂糖、食品添加剂 | |||||
| 项目 | 糖类 | 维生素 | 柠檬味酸 | 氯 | 钠 | 碘 |
| 每100g | 42.5g | 200mg | 100mg | 50mg | 90mg | 3.5mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银悬浊液中滴加0.1mol/L Na2S溶液 | |
| B. | 向50mL NO中通入5mL空气 | |
| C. | 98%浓硫酸中加入Cu片 | |
| D. | 把盐酸滴加到含酚酞的NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44 s | B. | 1 s | C. | 1.33 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应 | B. | 化合反应 | C. | 分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+、Na+、SO32-、NO3- | B. | 氨气:K+、Na+、AlO2-、CO32- | ||
| C. | 二氧化硫:Na+、NH4+、SiO32-、C1- | D. | 乙烯:H+、K+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
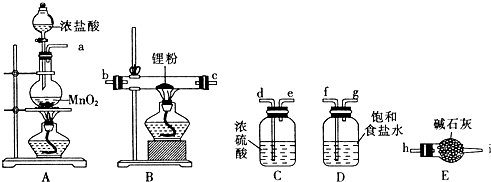
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com