
11分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电极b上发生的电极反应为___________________________________。
(2)电极b上生成的气体在标状况下的体积为__________________,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)_______________。
(3)电极c的质量变化是___________g,欲使电解后乙中的电解液恢复到起 始状态,应该向溶液中加入适量的___________(填字母编号)。
始状态,应该向溶液中加入适量的___________(填字母编号)。
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D. Cu2(OH)2CO3 Cu2(OH)2CO3 |
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源:2013届安徽省望江二中高三第三次月考化学试卷(带解析) 题型:实验题
(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有
关实验:
(1)先关闭活塞a,将6.4 g铜片和12 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失.
①写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞a之前 ;
打开活塞a之后 。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中试剂为: (填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用 作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为 ,再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为 mol(用含a、b的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 2.2 物质的制备练习卷(解析版) 题型:填空题
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:______________、______________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是________________、________________。
Ⅱ.乙酸正丁酯精产品的制备
(1)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤,正确的操作步骤是__________(填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
(2)将酯层采用如下图所示装置蒸馏。
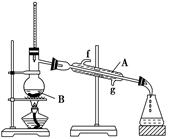
①写出上图中仪器A的名称______________,冷却水从__________口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在__________左右。
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成水的体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率为__________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三第三次月考化学试卷(解析版) 题型:实验题
(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有
关实验:

(1)先关闭活塞a,将6.4 g铜片和12 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失.
①写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞a之前 ;
打开活塞a之后 。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中试剂为: (填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用 作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为 ,再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为 mol(用含a、b的表达式来表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com