
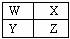
| A.Y的化学活泼性一定比W强 |
| B.Y元素的原子半径可能比X元素的原子半径小 |
| C.Z的气态氢化物的稳定性一定比X的强 |
| D.Z的原子序数可能是X的原子序数的2倍 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | X | Y | |
| Z | | | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤⑥⑦⑧ | B.①④⑤⑥⑦ |
| C.④⑤⑥⑦⑧ | D.④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HClO4>H3PO4>H2SO4 | B.氢化物稳定性:H2S>HF>H2O |
| C.氧化性:F2>Cl2>Br2>I2 | D.碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com