
有三种说法:①NH4NO3中氮元素显+5价;②4FeS2+11O2→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是 ( )
A.只有① B.只有②③ C.只有①③ D.①②③
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
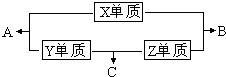 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象和结论 |
| 步骤1:用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管. | 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl. 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl. |
| 步骤2: 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡. 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡. |
固体溶解得无色溶液 固体溶解得无色溶液 |
| 步骤3: 试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 |
有白色沉淀生成,证明原白色粉末含有K2SO4 有白色沉淀生成,证明原白色粉末含有K2SO4 |
| 步骤4: 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 |
有白色沉淀生成,证明原白色粉末含有NaCl 有白色沉淀生成,证明原白色粉末含有NaCl |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| 8d3 |
| ||
| 8d3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com