
【题目】在25℃下,稀释HA、HB 两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,a点时,HB溶液中B的物质的量分数 ,下列说法正确的是
,下列说法正确的是

A. HA、HB都是弱酸
B. 加水稀释过程中,δ(B )减小
C. NaB溶液中,c(Na+)=c(B-)+c(OH-)
D. 曲线上b、c两点c(B-)/[c(HB)·c(OH-)]相等
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 . 相关数据如表:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1c2(填“>”“<”或“=”),a= .
④该温度下反应的平衡常数K=;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= .
(2)已知反应:2NO2(红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是(填字母). 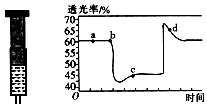
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成生物的最基本元素是C
B. 占人体细胞干重百分比最多的元素是O
C. H7N9病毒和桃树共有的元素是C、H、O、N、P
D. Cu、Mn、Mo、B都是组成生物体的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.①②④
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷(g)和反-1,2-二甲基环丙烧(g) 可发生如下转化:


该反应的速率方程可表示为: v(正)=k(正)c(順)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。1温度下,k(正)=0.006s-1 ,k(逆)=0.002s-1。下列说法错误的是
A. t1温度下,反应的平衡常数值K1=3
B. 该反应的活化能Ea(正)小于Ea(逆)
C. t2温度下,上图中表示顺式异构体的质量分数随时间变化的曲线为B曲线
D. 由上图信息可以确定温度t2小于t1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气中的NO2、CO2对环境具有极大影响,利用化学反应原理对其处理,对构建“绿水青山”生态文明有重要意义。请回答下列问题:
(1)下列说法正确的是_________
A.CO2和NO2与水反应所得溶液均为弱酸
B.NO2在一定条件下能与NH3反应生成环境友好的物质
C.通过测定溶液的pH,一定能判断H2CO3和HNO2的酸性强弱
D.Na2CO3溶液中加入硫酸可生成CO2
(2)H2在催化剂存在下能与NO2反应生成水蒸气和氮气而消去工业尾气中NO2的污染,
已知:①N(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol;②H2O(g)=H2O(1)ΔH=-44kJ/mol;③H2的燃烧热为285.8kJ/mol,该反应的热化学方程式为___________.
(3)CO2可在一定条件下转化为CH3OH。己知向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂和T1温度下,发生反应:CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(1)+H2O(1)ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
0min | 2 | 6 | 0 | 0 |
10min | 4.5 | |||
20min | 1 |
①前10min内的平均反应速率v(CO2)=_______,20min时H2的转化率为_______。
②在其他条件不变的情况下,若30min时只改变温度为T3,达平衡时H2的物质的量为3.2mol,则T2______T3(填“>”“<”或“=”),在温度T2时,反应的化学平衡常数为______。
③在T1温度下,将容器容积缩小一倍,反应达平衡时CH3OH物质的量为____mol.和改变下列条件,能使H2的反应速率和转化率都一定增大的是____(填标号)。
A.在容积不变下升高温度
B.其它条件下不变,增加压强
C.在容积和温度不变下充入N2
D.在容积和温度不变下及时分离出CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质: A.O2 和 O3
B. ![]() O 和
O 和 ![]() O
O
C.CH3﹣CH2﹣CH2﹣CH3和CH3﹣CH(CH3)CH3
D.三氯甲烷和氯仿
E.甲烷和庚烷
F.异丁烷和 2﹣甲基丙烷
(1)组互为同位素;
(2)组两物质互为同素异形体;
(3)组两物质属于同系物;
(4)组两物质互为同分异构体;
(5)组是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.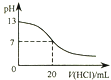
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.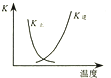
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.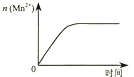
图③表示10 mL 0.01 molL﹣1 KMnO4 酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com