
【题目】容积不变的密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是
2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是

A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式中错误的是( )
A. Na2CO3=Na2++CO32- B. Na2SO4=2Na++SO42-
C. Ba(OH)2=Ba2++2OH- D. MgCl2=Mg2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 氨水中加酸,NH4+ 的浓度增大
B. 装有NO2和N2O4平衡的混合气体的玻璃球在冷水中气体颜色变浅
C. 实验室中常用排饱和食盐水的方法收集Cl2
D. H2、I2、HI的体系平衡后,加压混合气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A. 氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B. 在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型化工材料I(结构简式为 )的合成路线如下,请回答下列问题:
)的合成路线如下,请回答下列问题:

(1)A的名称为_____________;E的结构简式为___________,其核磁共振氢谱显示为______组峰;试剂甲的名称是_____________。
(2)A→B反应的有机反应类型是_________;G→H反应的有机反应类型是________。
(3)物质I中含氧官能团的名称是_____________、_____________。
(4)D和H反应的化学方程式为_____________。
(5)写出一种同时符合下列条件的G的同分异构体的结构简式:_____________。
①含有苯环;
②含有三个取代基,且有一取代基在甲基的对位;
③苯环上有三种不同化学环境的氢原子。
(6)参照上述合成路线,以CH3CH2Br和CH3COOH为原料(无机试剂任选),设计制备CH3COOCH2CH2OOCCH3。____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当密闭容器中合成氨反应N2+3H2![]() 2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
2NH3达到平衡后,保持温度不变,将容器的容积压缩为原来的1/2。达到新平衡后,与原平衡相比较,下列说法中正确的是
A. 容器内的总压强为原来的2倍 B. N2的浓度比原来平衡浓度小
C. H2的转化率为原来的2倍 D. 气体的密度为原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
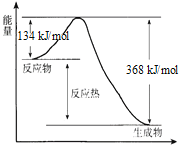
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.简单离子的半径先减小后增大,卤素离子半径最大
b.元素金属性减弱,非金属性增强
c.最高价氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点逐渐降低
(2)原子最外层电子数是次外层电子数一半的元素名称为____,还原性最弱的简单阴离子是____。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 共价化合物 | |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是________________________________,根据熔点推测Al2O3是___________化合物。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____________,在上述由SiCl4(g)制纯硅的反应中,测得每生成0.56 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_____________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,但可用P2O5干燥的是_________。
a.HI b.NH3 c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com