
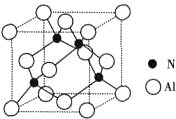
 由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$. 分析 根据晶胞的结构可知,每个晶胞中含有N原子数为4,Al原子数为$\frac{1}{8}$×$8+\frac{1}{2}×6$=4,根据$ρ=\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长,N原子位于晶胞体对角线的$\frac{1}{4}$处,所以晶胞中最近的两个N原子之间的距离为面对角线的$\frac{1}{2}$,据此答题.
解答 解:根据晶胞的结构可知,每个晶胞中含有N原子数为4,Al原子数为$\frac{1}{8}$×$8+\frac{1}{2}×6$=4,根据$ρ=\frac{m}{V}$可知晶胞的体积为$\frac{\frac{4×41}{{N}_{A}}}{ρ}$=$\frac{164}{{N}_{A}ρ}$,所以晶胞的边长为$\root{3}{\frac{164}{{N}_{A}ρ}}$,则晶胞的面对角线长为$\sqrt{2}$×$\root{3}{\frac{164}{{N}_{A}ρ}}$,N原子位于晶胞体对角线的$\frac{1}{4}$处,所以晶胞中最近的两个N原子之间的距离为面对角线的$\frac{1}{2}$,所以胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$,
故答案为:$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
点评 本题考查晶胞计算及晶胞的结构,难点是均摊法的运用,知道密度公式中各个字母含义,题目难度中等,注意立体几何知识的灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
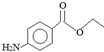
| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2012年,随着两会顺利召开,保障房建设成为热点.住宅建设离不开硅酸盐材料,工业玻璃、水泥、陶瓷都要使用石灰石做原料,钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 | |
| B. | 去年底,世界气候大会在南非德班召开.开发新型能源是践行低碳生活的有效途径之一,生物质能是指来源于动植物及其加工产品所储存的能量 | |
| C. | 近年食品安全倍受关注,某媒体披露“皮革奶”事件.有不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量.动物皮革的主要成分是蛋白质,“皮革奶”灼烧时有烧焦羽毛的气味 | |
| D. | 氯化钙及氯化镁等“化冰盐”是冰融化成水的反应催化剂,在雪地里加入化冰盐可快速消除冰雪 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
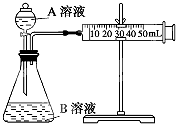 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
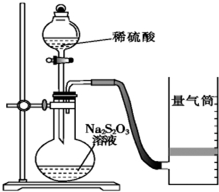 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由mXa+与nYb-得,m+a=n-b | |
| B. | 由mXa+与nYb-得X和Y不同周期 | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X离子是阴离子,则Y离子一定是阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com