
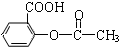 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.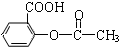 )计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.
)计算0.25g阿斯匹林样品反应消耗的NaOH的物质的量,并以此计算产品中乙酰水杨酸的含量.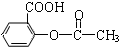 反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,
反应的氢氧化钠的物质的量为0.005mol-0.0025mol=0.0025mol,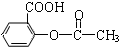 ),则m(
),则m(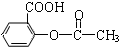 )=0.0025mol×
)=0.0025mol×| 1 |
| 3 |
| 0.15g |
| 0.25g |


科目:高中化学 来源: 题型:
| A、某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 |
| B、盐类水解的过程破坏了水的电离平衡 |
| C、室温时向AgCl饱和溶液中加入AgNO3固体,c(Cl-)不变 |
| D、室温时pH=3的溶液与pH=11的溶液等体积混合所得溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| 1 | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| 2 | 在氢氧化钠溶液中滴加少量氯化铝:Al3++3OH-═Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
| 3 | 铁加入到过量的稀硝酸溶液中:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确 |
| 4 | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多: 3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
错误,Al3+与OH-的化学计量数之比为1:3 |
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、上述元素中,A的最高价氧化物对应的水化物酸性最强 |
| B、简单离子的半径依A、B、C、D的顺序依次减小 |
| C、工业上可通过电解H的熔融氯化物的方法制备H的单质 |
| D、F的简单离子与C、D的简单离子构成的化合物都是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出)
在如图所示的物质转化关系中A是一种活泼的金属,B是无色液态化合物,其分子含10个电子,在常温下F、H都是无色气体.(生成的水没有列出)查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.| 盐酸溶液体积/mL | 40.00 | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.200 | 10.80 | 14.40 | 21.60 |
| CO2质量/g | 3.080 | 4.620 | 3.520 | 0.880 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
(I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A的分子式为C3H6O2转化关系如图:
化合物A的分子式为C3H6O2转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B、在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C、第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D、非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com