
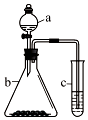
 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )| 选项 | a | b | c | c试管中现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.高锰酸钾与浓盐酸反应生成氯气,氯气可氧化氯化亚铁;
B.Na2S2O3与稀硫酸反应生成S、二氧化硫,二氧化硫与溴水反应生成硫酸和HBr;
C.硼酸与Na2CO3不反应;
D.常温下Fe遇浓硝酸发生钝化.
解答 解:A.高锰酸钾与浓盐酸反应生成氯气,氯气可氧化氯化亚铁,生成氯化铁,则观察到c中溶液变棕黄色,故A正确;
B.Na2S2O3与稀硫酸反应生成S、二氧化硫,二氧化硫与溴水反应生成硫酸和HBr,则观察大瓶c中溶液为无色,故B错误;
C.硼酸与Na2CO3不反应,c中无现象,故C错误;
D.常温下Fe遇浓硝酸发生钝化,则c中无现象,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应和现象、实验装置的作用为解答本题的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置或操作 |  | 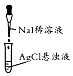 | 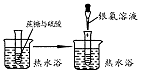 | 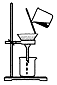 |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
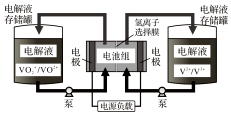 全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )| A. | 放电时,正极电极反应为:VO2++e-+2H+=VO2++H2O | |
| B. | 充电时,阴极电极反应为:V3++e-=V2+ | |
| C. | 放电时,H+从电池右边移向左边 | |
| D. | 利用该电池电解饱和NaCl溶液(石墨作电极),2 mol VO2+发生氧化反应时,可生成气体44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
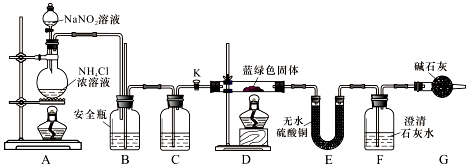
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SiO3溶液的pH | Na2SiO3溶液的pH大 | 非金属性:C>Si |
| B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备CO2 |
| C | 将4mL 0.01mol/L酸性KMnO4溶液与2mL 0.lmol/L草酸溶液混合 | KMnO4溶液褪色的速率先慢后加快 | 增大反应物浓度, 反应速率加快 |
| D | 将NO2气体通入石蕊试液中 | 溶液变红 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
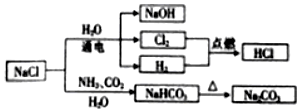
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 图中所示转化反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | H2与Cl2反应时产生苍白色火焰并形成白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1 Na2CO3溶液的pH约为11;0.1mol•L-1 NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com