
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: | |
| C. | 乙醇的分子式C2H6O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{131}$I |
分析 A.比例模型反应原子的大小,碳原子半径小于氢原子;
B.甲基中含有3个碳氢键,碳原子最外层为7个电子,C最外层有4个电子,则甲基中有1个单电子;
C.根据乙醇的分子组成进行判断;
D.原子符号ZAX,z代表质子数,A代表质量数,X代表元素符号.
解答 解:A.黑色球表示C原子,C原子比H原子大,乙烯的比例模型为 ,故A错误;
,故A错误;
B.C最外层有4个电子,则甲基中有1个单电子,则甲基的电子式为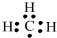 ,故B错误;
,故B错误;
C.乙醇分子中含有2个C、6个H和1个O,乙醇的分子式为:C2H6O,故C正确;
D.碘原子质子数为53,中子数为78,质量数=质子数+中子数=131,碘原子:${\;}_{53}^{131}$I,故D错误;
故选C.
点评 本题考查化学用语,涉及比例模型、电子式、分子式等,注意区分及规范使用化学用语,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中气体的颜色不变 | B. | 集气瓶中有火星出现 | ||
| C. | 集气瓶内壁上有油状液体出现 | D. | 集气瓶口有棕黄色烟出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 糖类、油脂、蛋白质都能发生水解反应 | |
| D. | 油脂有油和脂肪之分,都属于酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com