
����Ŀ����1��A��B��Ӧ����C���ٶ���Ӧ�տ�ʼֻ��A��B�����ǵ���ʼŨ�Ⱦ�Ϊ1mol/L����Ӧ����2min��A��Ũ��Ϊ0.8mol/L��B��Ũ��Ϊ0.6mol/L��C��Ũ��Ϊ0.6mol/L��������2 min�ڷ�Ӧ��ƽ������VA =_______ mol/(L�� min)��VB =________ mol/(L�� min)���÷�Ӧ2 min��A��B��C�������ʵĻ�ѧ��Ӧ����֮��Ϊ:________________________��
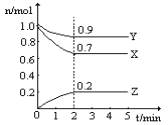
��2��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________________��
�ڴӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ______________________��
���𰸡� 0.1 0.2 1 ��2 ��3 3X+Y![]() 2Z 0.05mol/(L��min)
2Z 0.05mol/(L��min)
����������1�����ݷ�Ӧ�����ǵ�λʱ����Ũ�ȵı仯���������㣻
��2���������ʵı仯�жϷ�Ӧ�����������ݷ�Ӧ�����ǵ�λʱ����Ũ�ȵı仯�����㡣
��1��A��B��Ӧ����C���ٶ���Ӧ�տ�ʼֻ��A��B�����ǵ���ʼŨ�Ⱦ�Ϊ1mol/L����Ӧ����2min��A��Ũ��Ϊ0.8mol/L��B��Ũ��Ϊ0.6mol/L��C��Ũ��Ϊ0.6mol/L��������2 min�ڷ�Ӧ��ƽ������VA=��1mol/L��0.8mol/L����2min=0.1 mol/(L��min)��VB=��1mol/L��0.6mol/L����2min=0.2 mol/(L��min)����Ӧ����֮������ͬʱ����Ũ�ȵı仯��֮�ȣ��÷�Ӧ2 min��A��B��C�������ʵĻ�ѧ��Ӧ����֮��Ϊ0.2��0.4��0.6��1��2��3��
��2���ٸ���ͼ���֪x��y�����ʵ������٣��Ƿ�Ӧ�z�������2minʱ��Ӧ�ﵽƽ��״̬����ʱx����0.3mol��y����0.1mol��z����0.2mol����˸��ݱ仯��֮���ǻ�ѧ������֮�ȿ�֪�÷�Ӧ�ķ���ʽΪ3X+Y![]() 2Z��
2Z��
�ڴӿ�ʼ��2min��Z��Ũ�ȱ仯����0.2mol��2L��0.1mol/L������ƽ����Ӧ����Ϊ0.1mol/L��2min��0.05mol/(L��min)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���ں����ܱ������У�CO2��H2�ڴ��������·�����Ӧ��CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)��CO2��H2��CH3OH��H2O��Ũ�Ⱦ����ٸı�ʱ������˵����ȷ����
CH3OH(g) + H2O(g)��CO2��H2��CH3OH��H2O��Ũ�Ⱦ����ٸı�ʱ������˵����ȷ����
A. CO2��H2��CH3OH��H2O��Ũ��һ�����
B. �÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬
C. CO2��H2��ȫת��ΪCH3OH��H2O
D. CO2��H2�ķ�Ӧ���ʵ���CH3OH��H2O�ķ�Ӧ������Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮMgBr2 �ɹ㷺�����л���Ӧ��������ˮ�������ȡ�ʵ���ҿ���þм��Һ��Ϊԭ�ϣ�������ͼװ���Ʊ���ˮMgBr2,��ش�:
��1��ʶ����ͼ��������A��������______��B��_______
��2��ʵ��ʱ������װ��C�л���ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�����ĵ����ܽ�Һ�崵������ΪҺ�����________������;ʵ���в����ø�������������N2��ԭ���ǣ�___________________________________________________________

��3����֪:Mg��Br2��Ӧ���ҷ���;����(C2H5OC2H5)���ӷ���MgBr2�������ܷ������·�Ӧ:MgBr2+3C2H5OC2H5![]() MgBr2��3C2H5OC2H5+Q(Q>0);��Ӧ��Ϻ�ָ������£����ˣ���Һת������һ�������ƿ�У���ȴ��0��C,�������壬�ٹ��˵������Ѻ��廯þ��Ʒ����һ�ι��˳�ȥ��������_______�����˱����õ��IJ���������:_______��
MgBr2��3C2H5OC2H5+Q(Q>0);��Ӧ��Ϻ�ָ������£����ˣ���Һת������һ�������ƿ�У���ȴ��0��C,�������壬�ٹ��˵������Ѻ��廯þ��Ʒ����һ�ι��˳�ȥ��������_______�����˱����õ��IJ���������:_______��
��4������ƽ���ƶ���ԭ��˵���õ������Ѻ��廯þ������������ֽ⣬����ˮMgBr2��Ʒ��ԭ��: ______________________________
��5��Ϊ�ⶨ��Ʒ�Ĵ��ȣ�����EDTA(��дΪY4-)����Һ�ζ�����Ӧ�����ӷ���ʽ:Mg2++Y4-====Mg Y2-
�ٵζ�ǰ��ϴ�ζ��ܵIJ���������____________________________
�ڲⶨǰ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����0.0500mol/L��EDTA ����Һ�ζ����յ㣬����EDTA ����Һ26.50mL,������ˮMgBr2��Ʒ�Ĵ�����___________ (������������ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�NaOH��Һ�μӵ�H2X��Һ�У������Һ��pH��![]() ��
��![]() �ı仯��ϵ��ͼ��ʾ������������ȷ����
�ı仯��ϵ��ͼ��ʾ������������ȷ����

A. H2XΪ��Ԫǿ��
B. ��![]() =1ʱ����Һ��c(HX��)=c(H2X)
=1ʱ����Һ��c(HX��)=c(H2X)
C. NaHX��Һ��c(H+)<c(OH��)
D. ����ҺpH=4.6ʱc(HX��)>c (X2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����ͭ(CuSO4��5H2O)����ˮ���������[(NH4)2Fe(SO4)2��6H2O]������Ҫ�Ļ���ԭ�ϣ���;ʮ�ֹ㷺��
��ش���������������Ԫ���йص�һЩ���⡣
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ_______����̬ͭԭ�ӵĵ���ռ�ݵ�����ܲ����Ϊ_______ ��
��2����Ԫ�صĵ�һ������С�ڵ�Ԫ�أ���ԭ����_______ ��
��3��SO42-��H2O��NH4+�������У��ռ乹��Ϊ�����������_______��NH4+�е�ԭ�ӵ��ӻ����������_______��
��4��д����SO42-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_______ (дһ��)��
��5��Cu��Au�ĺϽ���γ������������ܶѻ��ľ��壬�ڸþ�����Cuԭ�Ӵ������ģ��þ�����д���ܣ���ԭ�ӿɽ��뵽Cuԭ����Auԭ�ӹ��ɵ��������϶�У������ľ����ṹ����ʯ�����ṹ(��ͼ)���ƣ��þ��崢���Ļ�ѧʽΪ_______�����þ�����ܶ�Ϊ��g.cm-3������Cuԭ����Auԭ�����ĵ���̾���d=_______cm(NA��ʾ�����ӵ�������ֵ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ԭ������������������ֶ�����Ԫ�أ�Xԭ�Ӻ���û�����ӣ������ڱ��У�Z��Y��W�����ڣ� Y��Z��W��ԭ������������֮��Ϊ17���������й�������ȷ����
A. Y��Z��W����λ��ͬһ����
B. Y��W�ֱ��γɵĺ������Ϊǿ��
C. Y��Z��W�ֱ��γɵļ��⻯���У�W�ļ��⻯����Է�����������۷�����
D. X��Y��Z��W�������ԭ�Ӹ�����Ϊ5: 1:4:1�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��Si���γɶ��ָ�Ӳ�Ȳ��ϣ���Si3N4,C3N4,SiC.
(1)Si3N4��C3N4��Ӳ�Ƚϸߵ���______,������_________.
(2)C��N���γ�һ����ʯī�ṹ���ϣ���ϳɹ�������ͼ��ʾ������ʯī�ṹ���ϻ�����Ļ�ѧʽΪ_________����ϳɹ������������谷�γɣ������谷��Nԭ�ӵ��ӻ���ʽ��_____________��

(3)C��N�����γ�һ����Ԫ��״�л�������(im)����ṹΪ![]() ��������[Co(im)6]SiF6�Ľṹʾ��ͼ����:
��������[Co(im)6]SiF6�Ľṹʾ��ͼ����:
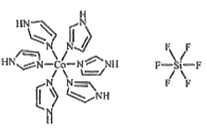
��Coԭ�ӵļ۲���ӹ������ʽ(�۲�����Ų�ͼ)Ϊ_____��N��Co֮��Ļ�ѧ��������___���жϵ�������__________��
��������SiF62-����ԭ��Si�ļ۲���Ӷ���Ϊ______��������(Co(im)6]2+��SiF62-֮������������Ӽ�ľ�����������������������ã�����������ı�ʾʽ_______��
����ˮ������ı�ʾʽΪ: ![]()
(4)SiCΪ������ϵ���壬��������Ϊa,��֪Siԭ�Ӱ뾶ΪrSi,Cԭ�Ӱ뾶ΪrC,�þ�����ԭ�ӵķ�������Ϊ:

��SiC���������к���____��Siԭ�ӡ�____��Cԭ�ӣ��þ�����ԭ�ӵ����ռ��������İٷ���Ϊ__________(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��ʱAgCl��Ksp=4��10��10 �� ����˵������ȷ���ǣ������� 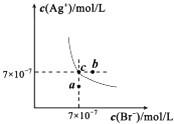
A.��t��ʱ��AgBr��KspΪ4.9��l0��13
B.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C.ͼ��a���Ӧ����AgBr�IJ�������Һ
D.��t��ʱ��AgCl��s��+Br����aq��AgBr��s��+Cl����aq��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ����Ҫ��ѧ�ɷֵ������У�����ȷ���� ��������
A. ������֭�е����Ǻ�ֲ��ϸ���е���ά�ض����ڶ���
B. ���̴���ά����D������֬��
C. �������Ǻ�����Ⱦɫ�����Ҫ�ɷ�֮һ
D. �����ʵĶ������백��������ࡢ��Ŀ������˳����й�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com