
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:填空题
(9分)钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
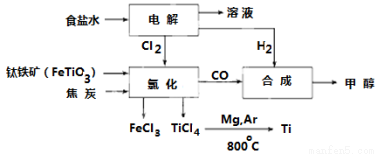
请回答下列问题:
(1)Fe位于元素周期表中第____________周期,第___________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:实验题
用 18 mol/L 的浓硫酸配制 100 mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL , 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。 A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的具体操作是_____________________________________
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④加水超过刻度线后, 用胶头滴管吸出多余的液体___________。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经过以下四步骤完成,各步骤中选用的实验用品正确且完整的是

A.将茶叶灼烧灰化,选用①、②
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤
D.检验滤液中的Fe3+,选用③、⑧、⑩
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列做法不能体现低碳生活的是
A.注意节约用水 B.减少食品加工过程
C.发展氢能和太阳能 D.大量使用化石燃料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:选择题
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,
②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。
由此判断下列说法正确的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序:Cl2>Br2>I2> Fe3+
D.还原性强弱顺序:I-> Br->Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=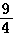 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中测试理综化学试卷(解析版) 题型:推断题
聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:
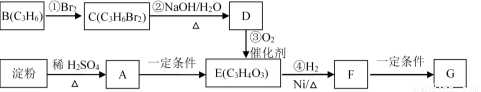
已知:
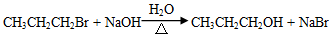
请回答下列问题:
(1)物质A的分子式为 ,B的结构简式为 ;
(2)请写出F中含氧官能团的名称 ;
(3)反应①~④中属于加成反应的是 ;
(4)写出由F生成聚合物G的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省无锡市四校高一上学期期中测试化学试卷(解析版) 题型:填空题
请按要求,回答下列问题:
(1)漂白粉有效成分的化学式为 ,其能消毒杀菌的原因是 (用化学方程式表示)
(2)小苏打可用于治疗胃酸过多,其反应的离子方程式为 。
(3)标准状况下3.36 L某气体的质量为8.1 g,则该气体的摩尔质量为 g/mol。
(4)某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com