
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A. 2.0gH218O与D216O的混合物中所含中子数为NA
B. 0.1molCl2溶于足量水中,转移的电子数为0.1NA
C. 常温常压下50g46%的乙醇溶液中,所含氧原子数目为0.5NA
D. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 g
D. AlN中氮的化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A.易形成-1价离子B.从上到下原子半径逐渐减小
C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是

A. 最高价氧化物对应水化物的酸性Y>Z>W
B. 含Y元素的盐溶液一定显酸性
C. 原子半径:rW>rZ>rY>rX
D. X与W的气态氢化物可相互反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种的重要方法,下列分类合理的是
A. KCl和K2O都属于盐 B. H2SO4和HNO3都属于酸
C. KOH和Na2CO3都属于碱 D. SiO2和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用流程如下:
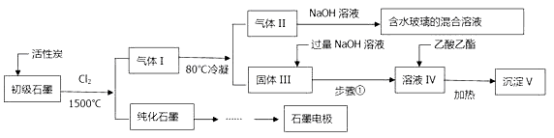
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式:
(2)向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。80℃冷凝的目的是: 由活性炭得到气体Ⅱ的化学反应方程式为:
(3)加入过量NaOH溶液得到溶液IV的离子反应方程式为:
(4)用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用: 。1kg初级石墨最多可获得V的质量为 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com