分析:(1)先根据v=
计算D的平均反应速率,再根据同一反应中,各物质的反应速率之比等于计量数之比,从而得出B的平均反应速率;
(2)反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
(3)根据化学平衡常数K=
计算;
转化率=
| 反应物起始的物质的量-反应物平衡的物质的量 |
| 反应物起始的物质的量 |
×100%;
根据图象中不同温度下,到达平衡时n(D)的物质的量,判断平衡移动,以此判断;
(4)根据浓度积与化学平衡常数的相对大小判断;
解答:解:(1)800℃时.0-5min内,D的平均化学反应速率
v(D)===0.06mol/Lmin,同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1=v(B):0.06mol/Lmin,v(B)=0.12mol?L
-1?min
-1;
故答案为:0.12mol?L
-1?min
-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确.
B、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故B正确;
C、2v正(B)=v逆(D),速率之比不等于化学计量数之比,反应未达平衡状态,故C错误.
D、无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误.
E、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量不变,混合物的质量不变,所以混合气体的平均分子量不再改变,所以能作为化学平衡状态的判断依据,故E正确.
F、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故F错误.
G、反应按照n(A):n(B):n(C):n(D)=1:2:1:1进行,开始n(A):n(B)不是1:2;到达平衡后,n(A):n(B):n(C):n(D)一定不是1:2:1:1,故G错误.
故答案为:ABE
(3)A(g)+2B(g)

C(g)+D(g),
起始 1.0mol 2.2mol 0 0
反应0.6mol 1.2mol 0.6mol 0.6mol
平衡 0.4mol 1.0mol 0.6mol 0.6mol
平衡时A、B、C、D各物质的浓度分别为0.2mol/L、0.5mol/L、0.3mol/L、0.3mol/l、
化学平衡常数K=
| 0.3mol/L×0.3mol/L |
| 0.2mol/L×(0.5mol/L)2 |
=1.8(mol?L
-1)
-1;
B的平衡转化率=
×100%=54.5%;
根据图象知,降低温度,D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应.
故答案为:1.8(mol?L
-1)
-1;54.5%;吸热.
(4)A、B、C、D各物质的浓度分别为1.1 mol/L、2.6 mol/L、0.9 mol/L、0.9 mol/L
浓度商Q
C=
| 0.9 mol/L×0.9 mol/L |
| 1.1 mol/L×(2.6 mol/L)2 |
=0.11(mol?L
-1)
-1<1.8(mol?L
-1)
-1,所以反应向正反应方向进行.
故答案为:向正反应方向.

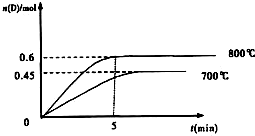 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应: C(g)+D(g),
C(g)+D(g),
