
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。

①甲池若为用电解原理精炼铜的装置,A极电极反应式为___________。
②乙池中若滴入少量酚酞溶液,开始一段时间后,____电极附近呈红色(填“铁”或“碳”)。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8 g时,则乙池阳极放出气体在标准状况下的体积为________(不考虑气体溶解情况)。
(2)肼(N2H4)—空气燃料电池是一种环境友好型碱性电池,该电池放电时,负极的反应式为_______。
(3)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。

①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式________________。
②电解结束后,阴极室溶液的pH与电解前相比将________(填增大、减小或不变);若两极共收集到气体13.44 L(标况),则除去的尿素为________ g(忽略气体的溶解)。
【答案】Cu2++2e-=Cu铁4.48LN2H4-4e-+4OH-=N2+4H2O3Cl2+CO(NH2)2+H2O=CO2+N2+6HCl不变7.2
【解析】
(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(CuSO4溶液或CuCl2溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,故答案为:Cu2++2e-=Cu;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑;Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡氢氧根离子浓度增大,铁电极附近溶液变红色,故答案为:铁;
(3)甲池A为电解池的阴极,电极反应为Cu2++2e-═Cu,增重12.8g的铜物质的量为0.2mol,转移电子物质的量为0.4mol;乙池Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,依据电子守恒,生成氢气0.2mol,放出气体在标况下的体积为0.2mol×22.4L/mol=4.48L, 故答案为: 4.48L.
(4)负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O.
(5)通过以上分析知,阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,故答案为:CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
(6)阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;若两极共收集到气体13.44L(标准状况),混合气体物质的量=![]() =0.6mol,根据CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知,n(N2)=n(CO2)=0.6mol×
=0.6mol,根据CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知,n(N2)=n(CO2)=0.6mol×![]() =0.12 mol,根据N原子守恒得n[CO(NH2)2]=n(N2)=0.12mol,尿素质量m=nM=0.12mol×60g/mol=7.2g,故答案为:不变;7.2。
=0.12 mol,根据N原子守恒得n[CO(NH2)2]=n(N2)=0.12mol,尿素质量m=nM=0.12mol×60g/mol=7.2g,故答案为:不变;7.2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。已知:
⑴凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
R-CH2-CHO+R1-CH2-CHO![]() R-CH2-
R-CH2-![]() -
-![]()
⑵ 2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
⑶ CH3-CH=CH2+H-Cl![]() CH3-
CH3-![]() -CH3
-CH3
合成路线如下:

(1)在反应②~⑦中,属于加成反应的是____________,属于消去反应的是____________。
(2)写出下列反应方程式:
E → F:____________________________________________________;
H → G:___________________________________________________。
(3)H也能与NaOH溶液反应,其反应方程式为______________________________,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化_______(选填“能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。

①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②506 K时,反应平衡时H2的转化率为___;压强:p1_____(填“>”“<”或“=”) p2。
③反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。

(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
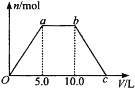
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电,电池负极反应为( )
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2-2e-=2H+
D.O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下图所示装置制取少量溴苯,并验证其中的一种产物。

请完成下列问题:
(1)在烧瓶a中装的试剂是________、________、________。
(2)导管c的下口能否浸没于液面下____________,理由是____________。
(3)反应过程中在导管c的下口附近可以观察到的现象是有_______出现,这是由于反应生成的_______遇水蒸气而形成的。
(4)反应完毕后,向锥形瓶d中滴加硝酸银溶液有________生成,反应的离子方程式是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从不同的角度,化合物可被分成不同的类别。下面的12种常见有机物,可依据不同的分类方法,将它们分为不同类别,填入下表。
⑴CH3-CH3 ⑵ CH2=CH2 ⑶ ![]() ⑷ CH3CH2OH ⑸
⑷ CH3CH2OH ⑸![]() ⑹CH3CH2Cl⑺
⑹CH3CH2Cl⑺![]()
⑻ CH3-CHCH3-CH2-CH3 ⑼ CH2=C(CH3)CH=CH2 ⑽ HOOC-CH(CH3)COOH
⑾![]() ⑿
⑿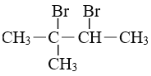
分类依据 | 有机化合物的序号 |
链状化合物 | ____ |
环状化合物 | ____ |
饱和烃 | ____ |
不饱和烃 | ____ |
芳香烃 | ____ |
醇类 | ____ |
羧酸类 | ____ |
卤代烃 | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是一种优良的有机溶剂,广泛用于硝化纤维清漆中,在人造革、织物及塑料加工过程中用作溶剂,也用于香料工业。某化学兴趣小组在实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据及实验装置如下所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解度(g/100 g水) |
冰醋酸 | 60 | 1.045 | 117.9 | 互溶 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
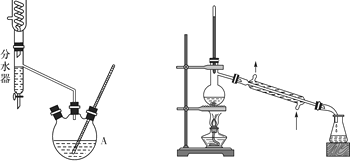
I II
分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
乙酸正丁酯合成和提纯步骤为:
第—步:取18.5 mL正丁醇和15.4 mL冰醋酸混合加热发生酯化反应,反应装置如图Ⅰ所示(加热仪器已省略);
第二步:依次用水、饱和Na2CO3溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置Ⅱ蒸馏提纯。
请回答有关问题:
(1)第一步装置中除了加正丁醇和冰醋酸外,还需加入___________、______________。
(2)实验中使用分水器的优点有________________、 ___________。根据题中给出的相关数据计算,理论上,应该从分水器中放出来的水的体积约为___________。
(3)第二步用饱和Na2CO3溶液洗涤的目的是____________________________。
(4)第三步蒸馏产品时,应收集温度在_______________左右的馏分。若实验中得到乙酸正丁酯12.76 g,则乙酸正丁酯的产率为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com