
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.770 0 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42—)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4—被还原为MnO2,其离子方程式为______________。
(3)通过计算确定样品的组成(写出计算过程)。
【解析】:(1)根据Ksp可得出c(Ba2+)=Ksp/c(SO42—)=1.1×10-10/1.0×10-6=1.1×10-4。(2)根据条件可知,非酸性条件下,MnO4—被还原为MnO2,则H2O2被氧化,氧化产物只能为O2,根据得失电子守恒,确定出MnO4—和H2O2的系数,再根据电荷守恒,确定出产物中含有OH-。(3)由②组数据可知沉淀为BaSO4,根据S元素守恒,可得n(Na2SO4)=n(BaSO4)=2.50×10-3 mol;由③组数据,再结合反应2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑可得出n?H2O2?=1.25×10-3 mol;再根据样品的质量,通过质量的关系得出样品中H2O的质量,进一步得出n?H2O?=2.50×10-3 mol;故x∶y∶z=n?Na2SO4?∶n?H2O2?∶n?H2O?=2∶1∶2。所以,硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O。
答案:?1?1.1×10-4
?2?2MnO4—+3H2O2=2MnO2+3O2+2OH-+2H2O
(3)n(Na2SO4)=n(BaSO4)=0.5825/233=2.50×10-3 mol
2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2
n(H2O2)=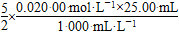 =1.25×10-3 mol
=1.25×10-3 mol
m(Na2SO4)=142 g·mol-1×2.50×10-3 mol=0.355 g
m(H2O2)=34 g·mol-1×1.25×10-3 mol=0.042 5 g
n(H2O)=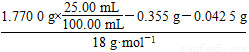 =2.50×10-3 mol
=2.50×10-3 mol
x∶y∶z=n(Na2SO4)∶n(H2O2)∶n(H2O)=2∶1∶2
硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试江苏卷化学 题型:058
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A.②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g.③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.02000 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL·H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+![]() 2Mn2++8H2O+5O2↑
2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1伊10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1.
(2)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为________.
(3)通过计算确定样品的组成(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠—过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.7700 g样品,配制成100.00 mL溶液A。
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.02000 mol·L—1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
则x∶z的比值为
A.1 B.2 C.4 D.0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com