
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. H+由a极通过固体酸电解质传递到b极
D. 每转移0.1 mol电子,消耗1.12L的H2
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
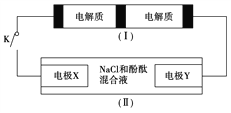
A. 闭合开关K时,Na+从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+
C. 闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
D. 闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,某溶液中含有Na+、H+、Fe3+、![]() 、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
、OH-、I-中的几种离子,已知由水电离出的c(H+)=1×10-13 mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
A. pH=1或pH=13
B. 阴离子肯定有I-,不能确定有无![]()
C. 阳离子肯定没有Fe3+,不能确定有无Na+
D. 溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在523K时,有以下反应:2HCl(g)+ CrO3(g)![]() CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
A.加热 B.使用催化剂 C.加压 D.分离出水气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)__________________,设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。

(2)用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式___________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO![]() ,试写出该反应的离子方程式____________________。
,试写出该反应的离子方程式____________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是溶液变红,电极反应为______________;乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为________________。

(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为__________________________、__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
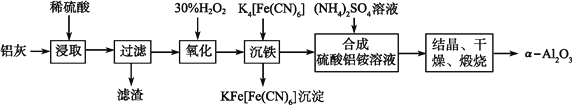
(1)写出铝灰与硫酸反应涉及的离子方程式_____________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为_________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
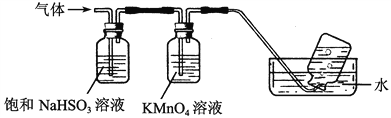
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生的离子反应方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com