
在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是( )。
A.2H2(g)+O2(g)=2H2O(l) ΔH1 2H2(g)+O2(g)=2H2O(g) ΔH2
B.S(g)+O2(g)=2SO2(g) ΔH1 S(s)+O2(g)=2SO2(g) ΔH2
C.C(s)+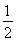 O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1  H2(g)+
H2(g)+ Cl2(g)=HCl(g) ΔH2
Cl2(g)=HCl(g) ΔH2
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:选择题
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成

下列说法正确的是( )。
A.香芹酮化学式为C9H12O
B.Cyrneine A可以发生加成反应、消去反应和氧化反应
C.香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D.与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题9非金属元素及其化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)??Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应过程如图:
2NH3(g) ΔH<0,反应过程如图:

下列说法正确的是 ( )。
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的平均反应速率v(H2)= mol·L-1·min-1
mol·L-1·min-1
D.10~12 min,升高温度使反应速率加快,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题4物质结构元素周期律练习卷(解析版) 题型:填空题
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。

请回答下列问题:
(1)这些元素的氢化物中,水溶液碱性最强的是________(写化学式),该氢化物的电子式为________。
(2)元素X和元素Y的最高价氧化物对应水化物的酸性较弱的是________,列举一个化学方程式证明________________________。
(3)元素Z与元素M组成的化合物中所含化学键类型为________,元素Z与元素X组成的化合物中所含化学键类型为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题3离子反应 氧化还原反应练习卷(解析版) 题型:选择题
铬(Cr)属于重金属元素,含铬的废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第______周期。
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。已知:

①FeSO4还原Cr2O72-的离子方程式为______________________________________________。
②Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________________。
③沉淀法分离废水中的Cr3+,pH应控制的范围是________。
④下列关于铬及其化合物的说法中正确的是________。
A.K2Cr2O7是一种常用的强氧化剂
B.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
C.金属铬硬度大、耐腐蚀,是常用的镀层金属
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题14实验化学(选修)练习卷(解析版) 题型:实验题
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应:

(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
A.H2O B.CCl4
C.NaHSO3 D.HNO3
(6)苯甲酸在不同温度下溶解度见下表:
T/℃ | 4 | 18 | 75 |
溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列离子方程式,书写正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.硫酸铝溶液中加入足量氨水:Al3++4OH-=[Al(OH)4]-
C.FeSO4溶液与稀硝酸反应:3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O
D.碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com