
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
分析 粗镍中含有少量Fe、Zn、Ag、Pt等杂质,粗镍做阳极,含镍离子的溶液做电解液,阳极锌、铁的还原性强于镍,电解时,锌、铁先失电子产生锌离子和亚铁离子,然后镍失电子产生镍离子进入溶液中,金属银、铂不失电子沉降电解池底部形成阳极泥,溶液中的金属阳离子中,镍离子氧化性最强,在阴极得到电子被还原为金属镍,据此解答.
解答 解:粗镍中含有少量Fe、Zn、Ag、Pt等杂质,粗镍做阳极,含镍离子的溶液做电解液,阳极锌、铁的还原性强于镍,电解时,锌、铁先失电子产生锌离子和亚铁离子,然后镍失电子产生镍离子进入溶液中,金属银、铂不失电子沉降电解池底部形成阳极泥,溶液中的金属阳离子中,镍离子氧化性最强,在阴极得到电子被还原为金属镍.
A.阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故A错误;
B.电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故B错误;
C.电解过程中阳极失电子的有Fe、Zn、Ni,阴极析出的是镍,依据得失电子守恒,阳极溶解的镍小于阴极析出的镍,所以电解后溶液中镍离子数目减少,故C正确;
D.金属银、铂不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中有Pt和Ag,故D错误;
故选C.
点评 本题考查了电解原理的应用,主要考查电解精炼镍的原理分析判断,明确粗镍中金属活泼性与金属阳离子氧化性强弱是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
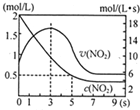 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: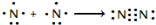 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 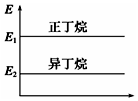 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com