
【题目】某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易升华;③淀粉溶液遇到碘单质变蓝色;④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
水 | 四氯化碳 | |
溴 | 黄→棕 | 橙→橙红 |
碘 | 深黄→褐 | 紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)

实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是____________________________,写出该反应的化学方程式__________________________________;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________,写出该反应的离子方程式_______________________;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为____________;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点______________
【答案】A中湿润的淀粉碘化钾试纸变蓝 Cl2+2KI═I2+2KCl 打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘 2I﹣+Br 2=2Br﹣+I2 Cl2>Br2>I2 B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应
【解析】
(1)装置①中可以生成氯气,氯气具有强氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝;反应的化学方程式是2KI+Cl2=2KCl+I2;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡、静置,观察到D中四氯化碳层呈紫色,说明溴的氧化性强于碘;该反应的离子方程式为Br2+2I-=2Br-+I2;
(3)根据上述两个实验,对同一个化学反应而言,氧化剂的氧化性大于氧化产物的氧化性,则Cl2>Br2,Br2>I2,所以氯、溴、碘单质的氧化性由强到弱的顺序为Cl2、Br2、I2;
(4)B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应,所以实验中要加过程Ⅲ这一步操作。


科目:高中化学 来源: 题型:
【题目】2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
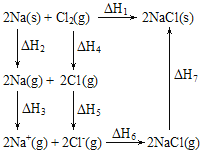
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C2H5OH B. CH4 C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
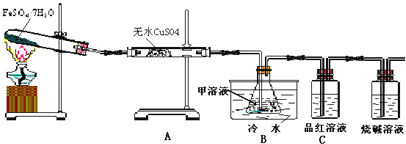
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是______;
(2)利用装置B可以确认的产物是______,装置B中的甲溶液可选(填序号)______。
①足量澄清石灰水②足量氯化钡溶液③足量硝酸钡溶液
该装置中冷水的作用是______;
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系最简方法的操作为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:

(1)装置A中发生反应的化学方程式:_________。
(2)装置D中试管口放置浸有NaOH溶液的棉花,其作用是______。
(3)装置B中应放置的液体是______。
(4)反应完毕,发现烧瓶中有铜片剩余,下列药品中能用来证明反应结束后的烧瓶中确有余酸的是______(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
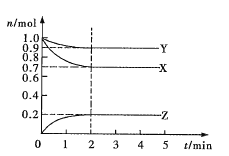
(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__FeO(填“>,<或=”),原因是_________。
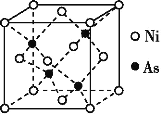
(3)NiAs的晶胞结构如图所示:
①Ni的配位数为____。
②若阿伏伽德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞中最近的Ni之间的距离为______cm。(写出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com