
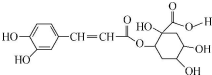
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
分析 A.连接四个不同原子或原子团的碳原子为手性碳原子;
B.酚能和氯化铁溶液发生显色反应;
C.苯环上 酚羟基邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应;
D.酚羟基和羧基、酯基水解生成的羧基能和NaOH反应.
解答 解:A.连接四个不同原子或原子团的碳原子为手性碳原子,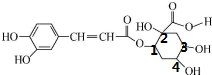 中有4个手性碳原子,故A正确;
中有4个手性碳原子,故A正确;
B.酚能和氯化铁溶液发生显色反应,该物质含有酚羟基,所以能和氯化铁溶液发生显色反应,故B正确;
C.苯环上 酚羟基邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应,1mol该有机物只能与4molBr2发生反应,故C错误;
D.酚羟基和羧基、酯基水解生成的羧基能和NaOH反应,1mol该有机物最多与4molNaOH反应,故D错误;
故选AB.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、烯烃、酯和羧酸性质,注意酚和溴发生取代反应位置,易错选项是C.


科目:高中化学 来源: 题型:解答题
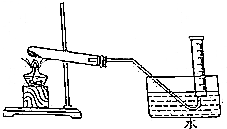 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
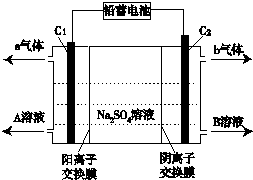
| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | CO2的比例模型: | |
| D. | 质子数为8,质量数为17的原子:${\;}_{8}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
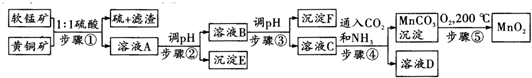
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 02是氧化剂,PtF6是还原剂 | |
| B. | 02 (PtF6)中氧元素的化合价为+1 | |
| C. | 02( PtF6)中不存在共价键 | |
| D. | 每生成1 mol O2 (PtF6)则转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
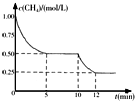 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com