
 (写结构简式).
(写结构简式). 分析 (1)根据气体的密度之比等于摩尔质量之比确定烷烃A的摩尔质量;根据烷烃的通式求出分子式,然后根据要求书写A的结构简式;
(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为$\frac{5}{12}$:$\frac{1}{1}$=5:12,可知该烃的实验式为:C5H12,1mol烃B中所含电子总数为42NA,可知该烃的分子式;一氯代物只有一种的是新戊烷.
解答 解:(1)因气体的密度之比等于摩尔质量之比,烃A蒸气的摩尔质量为2g/mol×64=128g/mol,若为烷烃,则12n+2n+2=128,解得n=9,所以烷烃A的分子式为C9H20,若为芳香烃,12个氢用1个碳代替,分子式变为C10H8;若A不可能是氢气与烯烃加成的产物,说明A中两个C间不可能存在C=C键,C只能构成4个键因此得到A的结构简式:(CH3)3CCH2C(CH3)3,
故答案为:C9H20或C10H8;(CH3)3CCH2C(CH3)3;
(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为$\frac{5}{12}$:$\frac{1}{1}$=5:12,可知该烃的实验式为:C5H12,电子总数为42(由于C已达饱和结构)所以实验式即为该烃的分子式;B的分子式为C5H12,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.一氯代物只有一种的是新戊烷,即为 ,
,
故答案为:C5H12; .
.
点评 本题考查了有机物分子结构的确定方法,为高频考点,要求学生具有分析和解决问题的能力,难度较大.确定B关键是求出实验式,可根据C4价或烃所含电子数来确定分子式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | Na2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置:用于制取并收集乙酸乙酯 | |
| B. |  如图装置:用于分离两种沸点不同的物质 | |
| C. |  如图装置:收集氨气时,从a口进气b口排气 | |
| D. |  如图装置:可用来快速制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
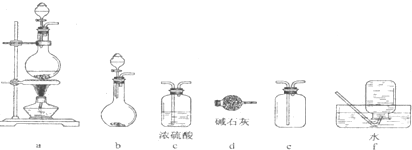
| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
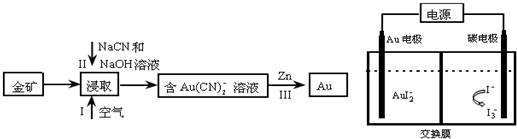
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
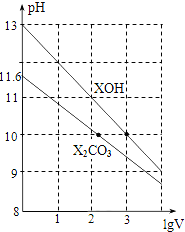
| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com