
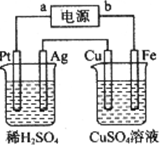
| A. | a极是直流电源的正极 | |
| B. | Fe极是阳极 | |
| C. | Pt极产生的气体体积是Ag极产生气体体积的2倍 | |
| D. | 硫酸铜溶液的浓度变大 |
分析 通电后观察到Cu极溶解,则Cu极为阳极,Fe极为阴极,故b、a、Pt、Ag极分别为:负极、正极、阳极、阴极,右池为电镀池,硫酸铜溶液的浓度不变,左边实质是电解水,以此解答.
解答 解:观察到Cu极溶解,则Cu极为阳极,Fe极为阴极,故b、a、Pt、Ag极分别为:负极、正极、阳极、阴极,右池为电镀池,硫酸铜溶液的浓度不变,左边实质是电解水.
A.Cu极溶解,应为电解池的阳极,阳极与电源的正极连,则a为正极,故A错误;
B.Fe连接电源的负极,为电解池的阴极,故B错误;
C.左边实质是电解水,2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,Pt为阳极发生氧化反应产生氧气,Ag为阴极发生还原反应产生氢气,则Pt极产生的气体体积是Ag极产生气体体积的2倍,故C正确;
D.右池为电镀池,硫酸铜溶液的浓度不变,故D错误;
故选C.
点评 本题考查电解池知识,侧重于电极判断和电解池工作原理的考查,为高考常见题型,注意把握铜极的变化判断电极为解答该题的关键,难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:推断题
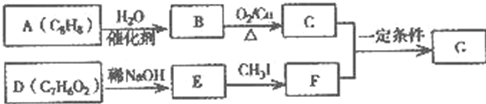

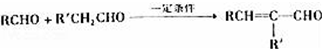
 .
. .
.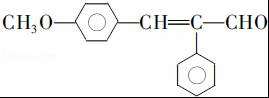 .
.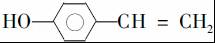 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
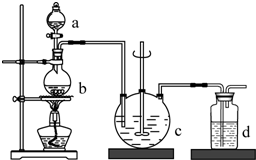 硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯中加入浓溴水和铁粉,加热,再加入AgNO3溶液,产生沉淀,说明苯和浓溴水发生了取代反应 | |
| B. | 实验室制备的乙炔气体通常具有一定的刺激性气味,依次通过NaOH溶液、浓硫酸洗气,获得纯净的乙炔 | |
| C. | 向2%的AgNO3溶液中逐滴滴加2%的氨水,直至产生的白色沉淀恰好消失,即配制得到银氨溶液 | |
| D. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 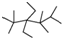 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 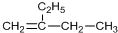 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(ClO)2溶液中通入少量SO2Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 向NH4HCO3溶液中加入足量NaAlO2溶液:NH4++2AlO2-+HCO3--+2H2O═NH3↑+2Al(OH)3↓+CO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
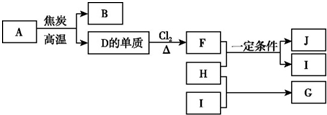 化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.
化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.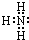 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com