
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A. H2S+2HNO3===S↓+2NO2↑+2H2O
B. CuO+2HNO3===Cu(NO3)2+H2O
C. 4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D. 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
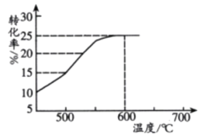
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,B的转化率提高
A.①②B.②④C.①③D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮(PTO)与PTO-Zn2+的相互转化,原理如图所示。下列说法正确的是
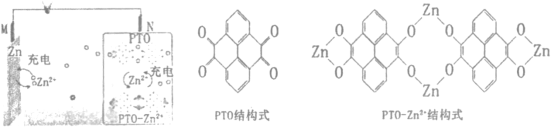
A.放电吋,N电极发生氧化反应
B.放电时,N极的电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+
C.充电时,M电极与电源负极相连
D.充电时,Zn2+向N极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块擦去氧化膜的铝片放入20 mL 0.5 mol·L-1 CuSO4溶液中,观察实验现象。下列方程式不正确的是
A.Cu2+(aq)+2H2O(l)Cu(OH)2(s)+2H+(aq) △H>0
B.2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0
C.Cu(OH)2(s)![]() CuO(s)+H2O(l) △H>0
CuO(s)+H2O(l) △H>0
D.2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较金属性的强弱:Na_________K(填“>”、“<”或“=”);反应Na+KClNaCl+K↑能发生的原因是________________。
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。写出COCl2的结构式__________。
(3)电解熔融氧化铝制备金属铝时,需要定期更换阳极石墨块,理由是_________________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于如下反应,其反应过程的能量变化示意图如图:
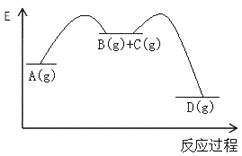
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g)=B(g)+C(g) | K1 | △H1 |
反应② | B(g)+C(g)=D(g) | K2 | △H2 |
反应③ | A(g)= D(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快D.则增大压强,K1减小,K2增大,K3不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com