

分析 (1)砷是33号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)气态SeO3分子中中心原子的价层电子对数可以判断分子构型;根据等电子体要求原子总数相同,价电子数相同来确定;
(4)①硼酸为一元弱酸,在水溶液里电离出阴阳离子;
②根据1个正硼酸分子能形成3个氢键,1个正硼酸分子能形成6个σ键,据此计算1mol H3BO3的晶体中氢键物质的量;
根据图知,正硼酸(H3BO3)中每个B原子连接3个O原子且不含孤电子对,据此确定B原子杂化方式;
(5)单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与晶硅中Si的结构相似;利用均摊法计算晶胞中Si原子数目,进而计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,计算晶胞棱长,进而计算晶胞体对角线.
解答 解:(1)砷是33号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3);
故答案为:1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3);
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为:Br>As>Se;
故答案为:Br>As>Se;
(3)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
故答案为:平面三角形;CO32-或NO3-;
(4)①硼酸为一元弱酸,在水溶液里电离出阴阳离子,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+;
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
②根据1个正硼酸分子能形成3个氢键,1个正硼酸分子能形成6个σ键,则1molH3BO3的晶体中氢键物质的量是3mol,σ键是6mol;
根据图知,正硼酸(H3BO3)中每个B原子连接3个O原子且不含孤电子对,据此确定B原子杂化方式为sp2;
故答案为:3;6;sp2;
(5)GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体;
该晶胞中Si个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,故晶胞质量为$\frac{8×28}{{N}_{A}}$g=$\frac{224}{{N}_{A}}$g,硅晶体的密度为ρg•cm-3,则晶胞棱长=$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm,则晶胞体对角线长度为$\sqrt{3}$•$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm,故最近的两个硅原子之间的距离为$\sqrt{3}$•$\root{3}{\frac{\frac{224}{{N}_{A}}}{ρ}}$cm×$\frac{1}{4}$=$\frac{\sqrt{3}}{4}$•$\root{3}{\frac{224}{ρ{N}_{A}}}$cm;
故答案为:4;正四面体;$\frac{\sqrt{3}}{4}$•$\root{3}{\frac{224}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、分子结构与性质、晶胞计算等,需要学生具备一定的空间想象与数学计算能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
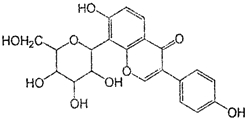
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
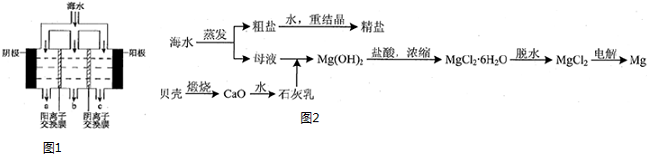
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L空气中O2、N2分子数为NA | |
| B. | 0.1mol羟基中所含电子数目为NA | |
| C. | 钠与氧气反应时,每消耗4.6g钠时生成的阴离子数目为0.1NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
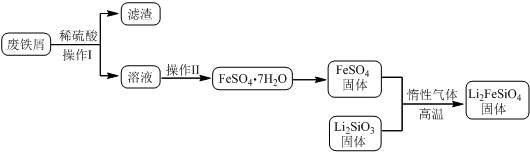
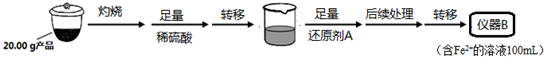
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com