
| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物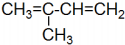 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
分析 A.不溶性杂质利用过滤分离,可溶性杂质利用结晶法分离;
B.乙炔、苯的最简式为CH,乙苯为C8H10;
C.溴水与乙醇不分层,溴水与甲苯分层后有机层在上层,溴水与溴苯分层后有机层在下层;
D.最左侧双键C上不能出现甲基.
解答 解:A.不溶性杂质利用过滤分离,可溶性杂质利用结晶法分离,不能利用分液,故A错误;
B.乙炔、苯的最简式为CH,乙苯为C8H10,则乙炔、苯的实验式相同,故B错误;
C.溴水与乙醇不分层,溴水与甲苯分层后有机层在上层,溴水与溴苯分层后有机层在下层,现象不同可鉴别,故C正确;
D.最左侧双键C上不能出现甲基,应为1,3-丁二烯结构,故D错误;
故选C.
点评 本题考查化合物分离提纯及物质鉴别,为高频考点,把握物质的性质、性质差异及发生的反应为解答该题的关键,侧重分析与应用能力的考查,题目难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
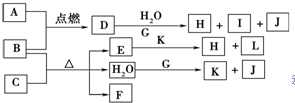 如图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,H为红褐色沉淀,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
如图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,H为红褐色沉淀,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
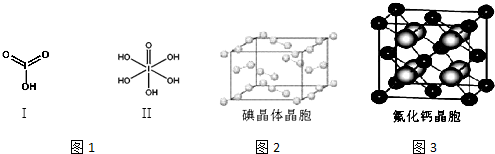
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com