
| A. | 化学键存在于原子之间,也能存在于分子与离子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的吸引力 | |
| D. | 化学键通常指的是任意两个或多个原子之间强烈的相互作用 |
分析 A、化学键存在于相邻的原子之间;
B、化学键是相邻原子之间强烈的相互作用;
C、阴阳离子之间的相互作用是金属键;
D、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用.
解答 解:A、化学键存在于相邻的原子之间,不存在于分子之间,也能存在于分子与离子之间的配位键,故A正确;
B、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,故B错误;
C、阴阳离子之间的相互作用是离子键,这种相互作用既包括吸引力也包括排斥力,故C错误;
D、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,而不是任意原子之间,故D错误;
故选A.
点评 本题考查了化学键的概念,难度不大,明确相邻的两个或多个原子之间的强烈的相互作用才是化学键,不相邻的原子之间的作用力不是化学键.


科目:高中化学 来源: 题型:解答题
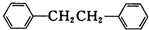 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: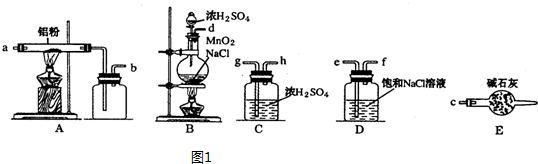
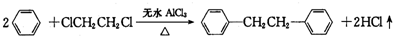
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2一二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
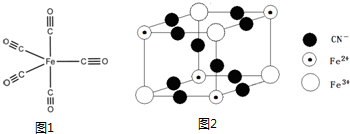
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
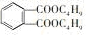 ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )| A. | DBP的分子式为C16H22O4 | |
| B. | 1mol DBP可以与5molH2反应 | |
| C. | 1mol DBP在碱性条件下水解时消耗4molNaOH | |
| D. | DBP所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
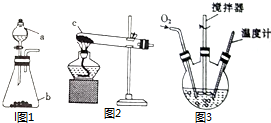 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在金刚石晶体中,围成最小环的原子数 | |
| C. | 在二氧化硅晶体中,围成最小环的硅原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | H3CHBrCHBrCH3 | D. | CH2BrCBr(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B | B. | AB2 | C. | B2A3 | D. | B3A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2易吸收空气中的水分 | |
| B. | Ca(ClO)2见光易分解 | |
| C. | Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO | |
| D. | Ca(ClO)2易被空气中的氧气氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com