
【题目】下列各组离子能共存的是:
A.K+、Cl-、HCO3-、H+B.NH4+、Cl-、OH-、SO42-
C.Na+、Cl-、Fe3+、NO3-D.Ba2+、Cl-、Al3+、SO42-
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
(1)该实验反应物与生成物有机物的官能团种类有(填写名称).
(2)试管a中加入几块碎瓷片的目的是 .
(3)试管a中发生反应的化学方程式为 , 反应类型是 .
(4)反应开始前,试管b中盛放的溶液是 . 作用是 .
(5)反应结束后,振荡试管b,静置.反应结束后,试管b内的液体分成两层,乙酸乙酯在层(填写“上”或“下”).若分离10mL该液体混合物需要用到的主要玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下元素周期表,以下说法正确的是
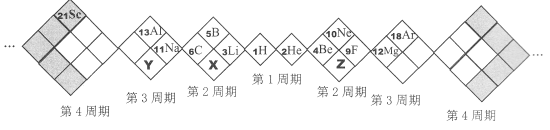
A. X、Y、Z元素分别为N、P、O
B. 所列元素都是主族元素
C. 原子半径:Z>X>Y
D. 稳定性:X的氢化物 < Y的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A.烧碱溶液 B.浓硫酸 C.饱和食盐水 D.浓盐酸
请回答下列问题:
(1)乙醇的沸点比丙酮沸点高的主要原因是 .
(2)加入甲溶液是 , (填A B C D序号),涉及到的反应方程式: .
(3)在70℃~85℃时馏出物的主要成分为 .
(4)在步骤④中加入过量的乙溶液是 . (填A B C D序号),
(5)最后蒸馏的温度控制在 .
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)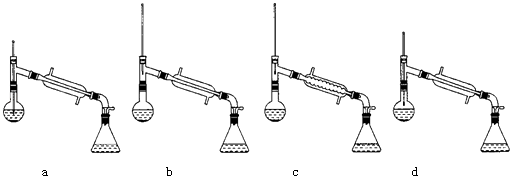
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是
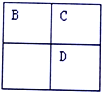
A. 简单离子的半径大小关系:B>C>E
B. 由C、E两种元素组成的两种离子化合物中,阴、阳离子个数比均为1:2
C. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
D. 已知A、B两种元素组成的离子化合物NH5与水生成气体A2及一种弱碱溶液,推出离子化合物NH5中阴、阳离子个数比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( ) ①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A,C,D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A.
A.①②⑤
B.②③④
C.②③⑥
D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥不同元素组成的多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A. ①③⑤ B. ②④⑥ C. ①③④ D. ③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )
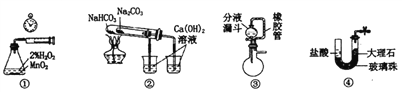
A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com