
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为____________。

(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制,确定溶液体积的容器是________(填名称)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.实验前,容量瓶中有少量蒸馏水.___________。
b.用量筒量取浓盐酸时俯视观察凹液面.__________。
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.__________。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的溶液,发现比①中所求体积偏小,则可能的原因是________________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
【答案】11.9 mol/L BD 16.8mL 500mL容量瓶 无影响 偏小 偏小 25mL C
【解析】
(1) 设溶液的体积为VL,再求出溶质的物质的量,代入公式求出物质的量浓度;
(2) 根据该物理量是否与溶液的体积有关判断;
(3)①根据稀释前后溶质的物质的量不变计算浓溶液的体积;
②分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(4)①根据n(HCl)=n(NaOH)计算;
②盐酸体积减少,说明标准液盐酸体积读数减小,逐项分析即可。
(1) 设盐酸的体积为VL,则溶质的质量为V×1000mL×1.19gcm-3×36.5%,溶质的物质的量为![]() =11.9Vmol,所以溶质的物质的量浓度为
=11.9Vmol,所以溶质的物质的量浓度为![]() =11.9mol/L;
=11.9mol/L;
(2) A.溶液中HCl的物质的量=cV,所以与溶液的体积有关,故A不选;
B.溶液的浓度c=![]() ,与溶液的体积无关,故B选;
,与溶液的体积无关,故B选;
C.溶液中Cl-的数目=nNA=cVNA,所以与溶液的体积有关,故c不选;
D.溶液的密度与溶液的体积无关,故D选;
故答案为BD;
(3)①配制480mL溶液,实验室没有480mL容量瓶,应该配制500mL 0.400mol/L的溶液,根据溶液稀释前后溶质的物质的量不变得c1V1=c2V2,V1=![]() =0.0168L=16.8mL;
=0.0168L=16.8mL;
②a.实验前,容量瓶中有少量蒸馏水,不影响最终溶液的体积和溶质的物质的量,即对所配溶液浓度无影响;
b.用量筒量取浓盐酸时俯视观察凹液面,溶质的量减小,所以配制的稀盐酸的物质的量浓度偏小;
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏小;
(4)①n(HCl)=n(NaOH)=0.01mol,V(HCl)=![]() =0.025L=25mL;
=0.025L=25mL;
②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了;
A.浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A不选;
B.配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B不选;
C.配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C选;
D.加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D不选;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列结构图中●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑 点代表未用于形成共价键的最外层电子,短线代表价键。示例
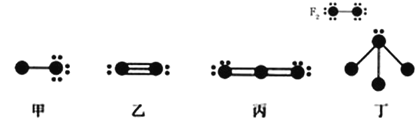
根据各图表示的结构特点,下列有关叙述正确的是
A.上述甲、乙、丙、丁结构图中共出现 6 种元素
B.甲、乙、丙为非极性分子,丁为极性分子
C.甲与丁可以发生化合反应,生成物中含有配位键
D.丁可以是 NH3,也可以是 NF3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
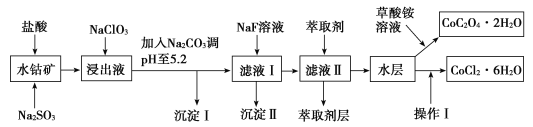
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3
(1)△H3=__________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应Ⅰ。下列描述能说明反应Ⅰ达到平衡状态的是_____________(填序号).
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应Ⅱ在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:

此时,v正_________v逆 (填“>”、“<”或“=”),当反应达到平衡时,混合气体中CH3OH体积分数(CH3OH)%=_________%。
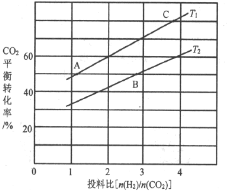
(4)反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;平衡常数K=_____(保留小数点后一位);KA、KB、KC三者之间的由大到小关系为______。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=![]() ×100%
×100%
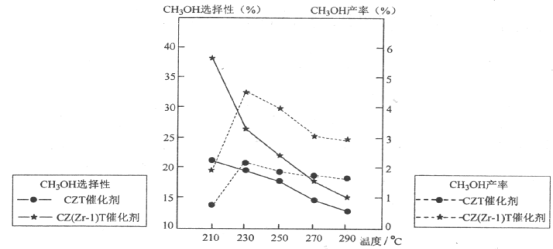
①温度高于230°C,CH3OH产率随温度升高而下降的原因是_______________。(答一条即可)
②在上述条件下合成甲醇的工业条件是___________________。
A.210°C B.230°C C.催化剂CZT D.催化剂CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。回答:
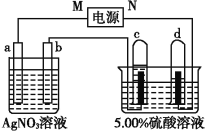
(1)直流电源中,M为________极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶________∶________∶________。
(4)AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),硫酸的浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是

A.H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
B.生成1 mol H2(g)中的H-H键放出121.5 kJ能量
C.断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量
D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=-92.5 kJ·mol-1
Cl2(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应Cu+2H2SO4![]() CuSO4+SO2↑+2H2O说法正确的是( )
CuSO4+SO2↑+2H2O说法正确的是( )
A.H2SO4是还原剂B.Cu在反应中被氧化
C.H2SO4在反应中只表现氧化性D.1mol氧化剂在反应中得到1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某反应的微观示意图,下列有关说法不正确的是

A. 生成的物质都是氧化物
B. 反应前后原子的种类不变
C. 该反应的基本类型属于置换反应
D. 反应方程式为2H2S+3O2 ![]() 2SO2+2H2O
2SO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.惰性电极电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.钢铁吸氧腐蚀中的正极反应:4OH-- 4e-=2H2O+O2 ↑
C.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com