
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
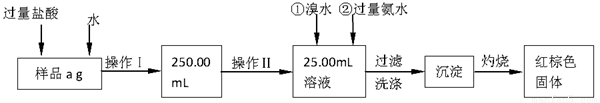
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 ;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
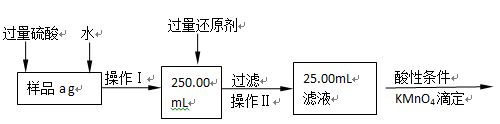
Ⅱ.有同学提出,还可以采用以下方法来测定:
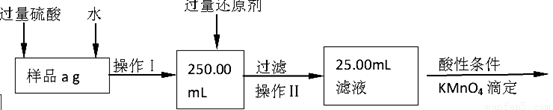
(1)溶解样品改用了硫酸,而不再用盐酸,为什么 ;
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
;
(3)若滴定用掉c mol•L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
Ⅰ.(1)250mL容量瓶(1分)、胶头滴管(1分)
(2)2Fe 2+ + Br2 = 2Fe 3+ + 2Br-(2分)
(3)再次加热冷却并称量,直至两次质量差小于0.1g(1分)
铁元素的质量分数是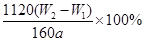 (2分)
(2分)
Ⅱ.(1)过量的盐酸对后面KMnO4的滴定有干扰(2分)
(2)否(1分)如果用铁做还原剂,自身的氧化产物是Fe2+;且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分,答出一个原因即给2分)
(3)铁元素的质量分数是 (2分)
(2分)
【解析】
试题分析:I、该实验的原理是:先将样品配成一定浓度的溶液,然后取其中的十分之一,加氧化剂将二价铁氧化为三价铁,然后加碱使铁生成氢氧化铁沉淀,灼烧沉淀使其变为氧化物,通过称量氧化物的质量计算出铁的质量,进而得出铁的质量分数。
(1)配制一定物质的量浓度的溶液所需仪器除了烧杯、玻璃棒外,还需要胶头滴管和容量瓶,由框图中溶液体积为250.00mL,故容量瓶要注明规格。
(2)加入溴水的目的是将二价铁氧化为三价铁,故反应为:2Fe 2+ + Br2 = 2Fe 3+ + 2Br-。
(3)将物质灼烧至恒重的标准是灼烧后连续两次称量质量差小于0.1g,但b1-b2=0.3g,因此还需要继续灼烧,直至两次质量差小于0.1g。灼烧后的固体为Fe2O3,其质量为:(W2—W1)g,其中铁的质量为: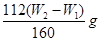 ,该质量为取样的十分之一,因此原样品中铁的质量分数为:
,该质量为取样的十分之一,因此原样品中铁的质量分数为: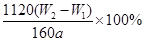 。
。
II、该实验的原理是将样品配成溶液,将其中的三价铁用还原剂还原为二价铁,取其十分之一,再用酸性高锰酸钾滴定二价铁,通过消耗的高锰酸钾的量计算出样品中铁的质量,进而求出铁的质量分数。
(1)盐酸中的Cl—具有还原性,可被高锰酸钾氧化,因此要将盐酸换为硫酸。
(2)若用铁作还原剂,发生的反应为Fe+2Fe3+=3Fe2+,Fe+H2SO4=FeSO4+H2↑,产生的Fe2+会干扰样品中铁的测量。
(3)二价铁被氧化为三价铁,每个Fe失去一个电子,KMnO4被还原为Mn2+,每个KMnO4得到5个电子,因此铁的物质的量是高锰酸钾物质的量的5倍,即n(Fe)=5×10-3bcmol,样品中铁的物质的量为5×10-2bcmol,故样品中铁的质量分数为: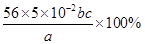 =
= 。
。
考点:考查化学实验常用仪器、基本操作,实验原理,实验流程分析,实验数据处理。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013届甘肃省河西五市部分普通高中高三第一次联合考试化学试卷(带解析) 题型:填空题
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤
进行实验: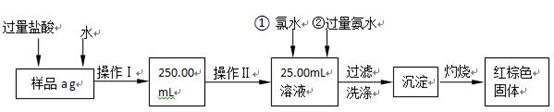
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有 。(填仪器名称)
(2)请写出加入氯水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定: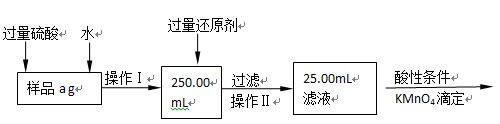
(1)选择的还原剂是否能用铁 (填“是”或“否”),原因是: ;
(2)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省东阳市黎明补校高三12月月考化学试卷(带解析) 题型:实验题
(共13分)某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热灼烧并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (含a、W1、W2的表达式)。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(4)选择的还原剂是否能用铁 (填“是”或“否”),原因是 。
(5)若一次滴定用去c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是 (含a、b、c的表达式)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省河西五市高三第一次联合考试化学试卷(解析版) 题型:填空题
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤
进行实验:
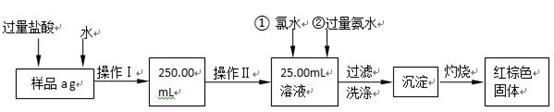
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有 。(填仪器名称)
(2)请写出加入氯水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)选择的还原剂是否能用铁 (填“是”或“否”),原因是: ;
(2)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省东阳市黎明补校高三12月月考化学试卷(解析版) 题型:实验题
(共13分)某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热灼烧并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 。若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (含a、W1、W2的表达式)。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(4)选择的还原剂是否能用铁 (填“是”或“否”),原因是 。
(5)若一次滴定用去c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是 (含a、b、c的表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com