
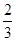 �ۣ����
�ۣ����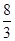 ��N��-
��N��-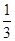 ����
����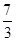 ���+2�ۣ�1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ
���+2�ۣ�1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ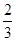 +6��
+6��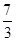 =
=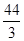 ���𰸣�ʧȥ 44/3��14.6����1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ
���𰸣�ʧȥ 44/3��14.6����1mol Pb(N3)2�ڷ�Ӧ�й�ʧȥ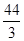 mol���ӣ�1molCr(MnO4)2�õ�6mol���ӣ�ʧȥ1mol���ӣ�����5mol���ӣ��ɵ�ʧ�����غ����ƽ����ʽ��Pb(N3)2ǰ��15��Cr(MnO4)2ǰ��44���ٸ��������غ㣬���ѽ�����ʽ��ƽ��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3���𰸣�15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3��
mol���ӣ�1molCr(MnO4)2�õ�6mol���ӣ�ʧȥ1mol���ӣ�����5mol���ӣ��ɵ�ʧ�����غ����ƽ����ʽ��Pb(N3)2ǰ��15��Cr(MnO4)2ǰ��44���ٸ��������غ㣬���ѽ�����ʽ��ƽ��15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3���𰸣�15 Pb(N3)2+ 44Cr(MnO4)2=5Pb3O4+90NO��+88MnO2+22Cr2O3��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ______ �� ______ �� N2O�� �� H2O
______ �� ______ �� N2O�� �� H2O Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2  CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Ӧ�е���������Cl2 |
| B���÷�Ӧ������ֻ�е�Ԫ�ر����� |
| C����ԭ�ԣ�CN-> Cl- |
| D������1 molCl2�μӷ�Ӧʱ��ת�Ƶĵ�����Ϊ2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������Ȼ�ԭ�����0��35mol����0��050molKNO3������ |
| B������������Ȼ�ԭ�����0��35mol������8��96LN2����״���� |
| C������0��2mol��������Ӧ����ת�Ƶ��ӵ����ʵ���Ϊ1��0mol |
| D��KNO3��������ǿ��N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��Na2CO3 | B��KMnO4 | C��XeO3 | D��Na2SO3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ǽ���Ԫ�أ�ϡ������Ԫ�س��⣩��������Ԫ�أ������ڷ�Ӧ�ж�ֻ���������� |
| B�������£�1 mol����������ϡNaOH��Һ��ȫ��Ӧת��1mol���� |
| C���ڼ��������£����Ҵ���ȥ���������е����� |
| D������ͭ��Һ�����Ե�ԭ��Cu2+ + 2H2O = Cu(OH)2��+ 2H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 BrO��
BrO�� BrO2-
BrO2- BrO3-�������й�˵����ȷ����
BrO3-�������й�˵����ȷ����| A��������������������ˮԭ����ͬ���������ý�������ԭ�� |
| B�������������������ɱ������������� |
| C��BrO- 3�����Ա�O3ǿ |
| D�����������εĹ����Ǹ�ˮ�����ĸ���Ӧ���������������BrO3-�IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ�Ļ�ѧ����ʽΪ��4NH3 + 3F2 �� NF3 + 3NH4F |
| B��M�Ǽ��Է��ӣ��仹ԭ�Ա�NH3ǿ |
| C��M��������������ǻ�ԭ���� |
| D��4moNH3�μӷ�Ӧʧȥ12mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ϸ�Ӧ | B���ֽⷴӦ | C���û���Ӧ | D�����ֽⷴӦ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com