
兔耳草醛是食品与化妆品工业中的香料添加剂。工业上可通过有机化工原料A制得,其合成路线如下图所示:
A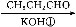 B
B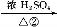 C
C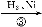 D
D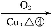
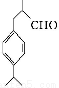 (兔耳草醛)
(兔耳草醛)
已知:①CH3CHO+CH3CHO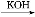 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
②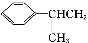 可写成
可写成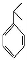
(1)B中含氧官能团的名称是 。
(2)上述合成路线中反应①属于 ,反应②属于 (填写反应类型)。
(3)写出由D获得兔耳草醛的化学反应方程式: 。
(4)A的同分异构体中符合以下条件的有 种。
a.能使FeCl3溶液显紫色
b.能发生加聚反应
c.苯环上只有两个互为对位的取代基
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
B.用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
C.蒸发硫酸铜溶液时蒸发皿放在石棉网上加热,并用坩埚钳夹取蒸发皿
D.向氢氧化铁胶体中逐滴加入稀硫酸,先出现红褐色沉淀,继续滴加稀硫酸,沉淀溶解得到黄色溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
依据元素周期表及元素周期律,下列推断正确的是( )
A.同周期主族元素的原子形成的简单离子电子层结构相同
B.C比Si的原子半径小,CH4的稳定性比SiH4弱
C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱
D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
第4周期元素由于受3d能级电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓(31Ga)的基态原子的电子排布式是 ;31Ga的第一电离能却明显低于30Zn的,原因是
。
Ⅱ.第4周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一对孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是 。
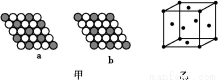
(3)图乙为一个铜晶胞,此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
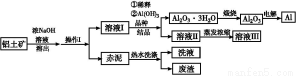
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g)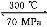 CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
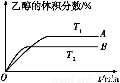
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.升温 B.加压
C.加催化剂D.增加CO2的浓度
(4)现有甲、乙两装置,甲装置为原电池,乙装置为电解池。
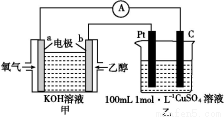
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
在第二周期中,B、C、N、O四种元素的第一电离能由大到小的排列顺序正确的是( )
A.I1(N)>I1(C)>I1(O)>I1(B) B.I1(N)>I1(O)>I1(B)>I1(C)
C.I1(N)>I1(O)>I1(C)>I1(B) D.I1(O)>I1(N)>I1(C)>I1(B)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.主族元素原子的最外层电子数等于元素的最高正化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com