
【题目】下列离子方程式书写正确的是
A. H2S溶液显酸性:H2S+2H2O![]() 2H3O++S2-
2H3O++S2-
B. 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-=SO42-+Cl-+2HC1O
C. 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D. 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
科目:高中化学 来源: 题型:
【题目】下列各组固体混合物分离操作正确的是
A. 碳酸钠和碳酸钙:溶解、过滤、蒸发(结晶)
B. 氯化钠和硫酸钠:溶解、过滤、蒸发(结晶)
C. 石灰石和氧化铁:溶解、过滤、蒸发(结晶)
D. 生石灰和碳酸钠:溶解、过滤、蒸发(结晶)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是
A. 漂白粉的有效成分是次氯酸钙和氯化钙 B. 漂白粉在空气中久置后会变质
C. 漂白粉是将氯气通入石灰水中制得 D. 漂白粉的主要成分是氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是
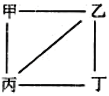
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节约能源、保护环境人人有责,请完成下列问题:
(1)垃圾的再生利用是垃圾资源化的最佳途径,啤酒瓶等玻璃容器可_______;废纸、废塑料可_______。
(2)要使垃圾中宝贵的再生资源得到充分利用,必须对垃圾进行_______。
(3)塑料、合成橡胶等合成高分子材料都是用_______经过聚合反应制成的。在一定条件下,这些高分子材料又能解聚成_______,从而得到循环利用。
(4)如图是垃圾箱上的标识:
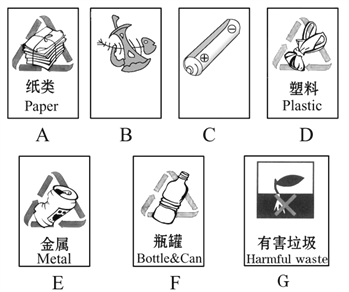
图B和图C的文字模糊不清,它们应分别表示____________和____________。
(5)垃圾处理的重要意义之一是控制环境污染,但在垃圾处理的过程中还要防止二次污染。下列处理垃圾的方法中有可能导致二次污染的是_______(填序号)。
①卫生填埋 ②堆肥 ③焚烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是:( )
A. 元素周期表有8个主族
B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期
D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,未来理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂使之水解成葡萄糖,再将葡萄糖转化成乙醇(葡萄糖在酒化酶的作用下可转化成乙醇和二氧化碳),用作燃料。
(1)请写出将绿色植物的秸秆转化为乙醇两步反应的化学方程式。
(2)现有1620t含纤维素约为50%的秸秆,理论上可制得80%的酒精多少吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
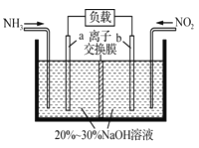
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
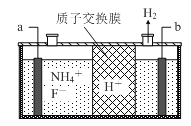
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )
A.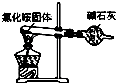
如图是氨气发生装置
B.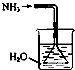
如图是氨气吸收装置
C.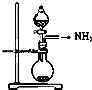
如图是氨气发生装置
D.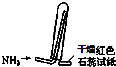
如图是氨气收集、检验装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com