
某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析?? 小组成员从理论上分析,认为下列分解产物不可能的是??????????? 。
a.Fe2O3、SO3、H2O??? ????????????????????? b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料? 常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
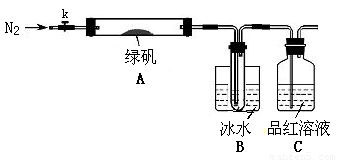
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为?????????????????????????????????????????????? 。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热
双通管。
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取
少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
( 4)实验结果分析
结论1:B中收集到的液体是?????????????????? 。
结论2:C中溶液褪色,可推知产物中有??????????????????? 。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:?????????????????????????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是?????????? 。
???? a. 氯水和KSCN溶液???? b. 酸性KMnO4溶液????? c. H2O2???? d. NaOH溶液
(1) a? (2分)
(3)①关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)H2SO4溶液? (2分)?? SO2? (1分)
(5)在C装置后增加一套尾气处理装置? (2分)
(6)b? (2分)
【解析】
试题分析:(1)加热FeSO4·7H2O发生氧化还原反应,氧化剂中有元素化合价降低,还原剂中有元素化合价升高,b、c项都有元素化合价的升高和降低,a中只有Fe元素化合价的升高,没有化合价的降低,故a项不可能。
(3)①利用加热时,气体体积膨胀检验装置的气密性,所以检查装置A与B气密性的操作为: 关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊,说明B中收集到的液体是H2SO4溶液;C中溶液时品红溶液褪色,说明加热FeSO4·7H2O有SO2产生。
(5)加热FeSO4·7H2O产生有毒的SO2,该装置没有尾气处理装置,所以应在C装置后增加一套尾气处理装置。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,Fe2+能使酸性KMnO4溶液褪色,所以最合适的为b项。
考点:本题考查氧化还原反应原理及应用、实验基本操作、物质和离子的检验、实验方案的设计及评价。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 .
.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I-. |
| 步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式是IO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉六中高三(上)11月联考化学模拟试卷(一)(解析版) 题型:填空题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com