
科目:高中化学 来源: 题型:
把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g)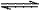 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度;
(2) B的转化率;
(3) x的值。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
A.①②⑤ B. ①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
无水氧化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下


通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a溶器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、
、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| 观察到的部分现象 | |
| 第一次实验 | 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 | 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 | 反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在乙酸、乙醇、乙酸乙酯、水构成的平衡体系中,加入少量含18O的水:H218O,一段时间后,可以检测到18O在哪些物质中
A.乙酸、乙酸乙酯、水 B.乙醇、乙酸乙酯、水
C.乙醇、水 D.乙酸、水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法中,错误的是( )
A.元素周期表是元素按原子序数从小到大从左到右排列而成的
B.主族元素原子的电子层数等于其所在周期的周期序数
C.四、五、六周期中都含有18种元素,其中Ⅷ族中所含元素种类最多
D.元素周期表中有18列、16个族,且第二列中无非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案如下:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度和质量相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________________。
(2)甲方案中说明HA是弱电解质的理由是测得溶液的pH______1
(选填“>”、“<”或“=”)。
(3)乙方案中说明HA是弱电解质的现象是 ____。
①装HCl溶液的试管中放出H2的速率快;
②装HA溶液的试管中放出H2的速率快;
③两个试管中产生气体的速率一样快。
(4)请你评价:乙方案中难以实现之处和不妥之处:
________________________________________________________________________。
(5)请你提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:
_______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com