
【题目】蚂蚁分泌的蚁酸主要成分是甲酸(结构式为 ![]() ,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
(1)该组同学选择如图1所示的装置探究HCOOH在浓硫酸作用下分解产生了CO,请完成下列各小题. 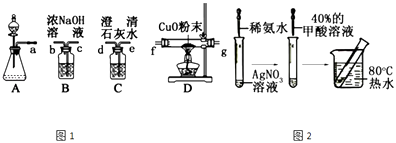
(i)写出甲酸分解的化学方程式;
(ii)装置的连接顺序a;
(iii)HCOOH的分解产物中有CO的现象;
(iv)该实验设计有一处明显的缺陷是;
(2)该组同学分析了甲酸分子结构后,认为甲酸能发生银镜反应,并设计了如图2所示的实验.
(i)依图所示的实验,加热20分钟后并没有出现光亮的银镜.请解释实验中没有产生银镜的原因;
(ii)请设计实验来验证你的解释 .
【答案】
(1)HCOOH ![]() CO↑+H2O;cbfged;D中黑色粉末变成红色,C中澄清石灰水变浑浊;无尾气处理装置
CO↑+H2O;cbfged;D中黑色粉末变成红色,C中澄清石灰水变浑浊;无尾气处理装置
(2)由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件;先将HCOOH用NaOH溶液中和至弱碱性,再加入到银氨溶液中进行银镜反应,若产生光亮的银镜,说明HCOOH发生银镜反应需在碱性环境下进行
【解析】解:(1)(i)甲酸在浓硫酸作用下易分解产生CO和水,方程式为:HCOOH ![]() CO↑+H2O,所以答案是:HCOOH
CO↑+H2O,所以答案是:HCOOH ![]() CO↑+H2O;(ii)根据实验原理探究HCOOH在浓硫酸作用下分解产生了CO,即将生成的气体首先通入氢氧化钠溶液除去可能含有的二氧化碳酸性气体,再通入CuO粉末加热还原,最后将生成的气体通入澄清石灰水来检验是否有二氧化碳生成,所以装置的连接顺序为acbfged,所以答案是:cbfged;(iii)根据(2)的装置连接,CO还原氧化铜生成红色的铜和二氧化碳,所以HCOOH的分解产物中有CO的现象是D中黑色粉末变成红色,C中澄清石灰水变浑浊,所以答案是:D中黑色粉末变成红色,C中澄清石灰水变浑浊;(iv)因为CO有毒,所以多余的CO要处理,则该实验设计有一处明显的缺陷是无尾气处理装置,所以答案是:无尾气处理装置;(2)(i)甲酸的结构为
CO↑+H2O;(ii)根据实验原理探究HCOOH在浓硫酸作用下分解产生了CO,即将生成的气体首先通入氢氧化钠溶液除去可能含有的二氧化碳酸性气体,再通入CuO粉末加热还原,最后将生成的气体通入澄清石灰水来检验是否有二氧化碳生成,所以装置的连接顺序为acbfged,所以答案是:cbfged;(iii)根据(2)的装置连接,CO还原氧化铜生成红色的铜和二氧化碳,所以HCOOH的分解产物中有CO的现象是D中黑色粉末变成红色,C中澄清石灰水变浑浊,所以答案是:D中黑色粉末变成红色,C中澄清石灰水变浑浊;(iv)因为CO有毒,所以多余的CO要处理,则该实验设计有一处明显的缺陷是无尾气处理装置,所以答案是:无尾气处理装置;(2)(i)甲酸的结构为 ![]() ,分子中含有醛基、羧基,应具有还原性和酸性等性质,理论上甲酸的醛基在碱性条件下被氧化银氨溶液氧化,产生光亮的银镜,而实验中没有出现预期的现象的可能原因是由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件,
,分子中含有醛基、羧基,应具有还原性和酸性等性质,理论上甲酸的醛基在碱性条件下被氧化银氨溶液氧化,产生光亮的银镜,而实验中没有出现预期的现象的可能原因是由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件,
所以答案是:由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件;(ii)根据甲酸的醛基在碱性条件下被银氨溶液氧化,所以可以先将溶液调成碱性再做银镜反应观察,则实验设计为:先将HCOOH用NaOH溶液中和至弱碱性,再加入到银氨溶液中进行银镜反应,若产生光亮的银镜,说明HCOOH发生银镜反应需在碱性环境下进行,所以答案是:先将HCOOH用NaOH溶液中和至弱碱性,再加入到银氨溶液中进行银镜反应,若产生光亮的银镜,说明HCOOH发生银镜反应需在碱性环境下进行.


科目:高中化学 来源: 题型:
【题目】向氯水中加入下列物质,表中各项均正确的是( )
选项 | 加入物质 | 现象 | 解释或离子方程式 |
A | AgNO3溶液 | 有白色沉淀生成 | Cl﹣+Ag+═AgCl↓ |
B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
C | CaCO3 | 有气体放出 | CO |
D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl﹣ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.用惰性电极电解MgCl2溶液:2Cl﹣+2H2O ![]() ?Cl2↑+H2↑+2OH﹣
?Cl2↑+H2↑+2OH﹣
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O
C.过氧化钠与水反应:2O22﹣+2H2O=4OH﹣+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH﹣+Al3++2SO42﹣=2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国“9·11”恐怖袭击给纽约带来了一场严重的环境灾害-石棉污染,易使吸入石棉纤维者患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,x、y的值可能分别为( )
A. 8、3B. 5、8C. 3、8D. 9、8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 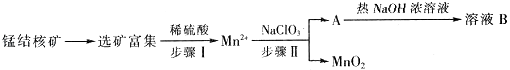
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化. 
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)下列变化属于放热反应的是 A.碳酸钙的分解反应 B.酸碱中和反应 C.碳和水蒸气的反应 D.浓硫酸稀释 E.实验室制取氨气 F.实验室制取氢气
(3)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2①以上两个反应能设计成原电池的是
②写出设计原电池正、负极电极反应式正极:负极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 水玻璃、玻璃、水泥、陶瓷均为混合物
B. CO2、SiO2、CO均为酸性氧化物
C. SiC的俗名叫金刚砂,硬度很大
D. 实验室熔融烧碱时,不能使用石英坩埚,可以使用铁坩埚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com