
利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图:
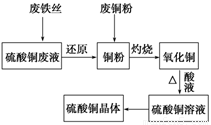
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
(1)除去铁丝表面的氧化物(2分)Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,(各3分)
(2)C或CO(2分)(3)①防止双氧水分解(2分)②CuO+H2SO4=CuSO4+H2O,(3分)
Cu+H2O2+H2SO4=CuSO4+2H2O(3分)(4)蒸发浓缩、冷却结晶(2分)
(5)生成等量的硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2(2分)
【解析】
试题分析:铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,是为了除去铁丝表面的氧化物发生反应的离子反应有Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:①灼烧不充分Cu未被完全氧化。②CuO未被充分还原。所用还原剂应该是C、CO。(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。反应时温度必须控制在50~60℃,温度不宜过高是为了防止高温时双氧水分解,发生的反应为:CuO+H2SO4=CuSO4+H2O,Cu+H2O2+H2SO4=CuSO4+2H2O(4)硫酸铜为强酸弱碱盐,由于硫酸没有挥发性,所以将溶液蒸发浓缩后,利用硫酸铜的溶解度受温度的影响变化较大。随温度的升高而增大,随温度的降低而减小。用冷却结晶法使其析出。(5)若采用直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,得到硫酸铜,因为发生反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,由于一部分硫酸反应生成了二氧化硫气体污染大气,所以比稀硫酸与氧化铜反应消耗的硫酸多,故在实际操作中较少。
考点:考查置换反应、复分解反应及氧化还原反应等反应在物质回收利用方面的应用和蒸馏结晶的混合物的分离等相关知识。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com