
(10�֣���֪H2SO3�Ƕ�Ԫ���ᣬ����������0��1 mol/L H2SO3��Һ����ش��������⣺
��1������H2SO3��Һ�м�������NaHSO3���壬��ʱ��Һ��c(H��)/ c(HSO3-)________(�������С�����䡱)��
��2������H2SO3��Һ�м����Ũ�ȵ�NaOH��Һ���Ҷ��ߵ������Ϊ2��3������Ӧ����Һ��ʹ��ɫʯ����ɫ����������Һ�������غ�ʽΪ0��1 mol/L��______________��������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����__________________��
��3������H2SO3��Һ�м���NaOH��Һ����Һǡ�ó����ԣ���ʱc(Na��)______2c(SO32��)(ѡ�>������<������)��
��4������H2SO3��Һ�м���һ����NaOH��Һ�����û��ҺpH��6�������Һ��
2c(SO32��) ��c(HSO3-)��c(Na��)��________mol/L��
��1����С ��2��c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) c(Na+)��c(SO32-)��c(HSO3-)��c(H+)��c(OH-)
��3�� �� �� 4 ) 10-6-10-8
��������
�����������1��H2SO3��Һ���ڵ���ƽ�⣬H2SO3 H++ HSO3-������NaHSO3����ʹ��c(HSO3-)��������c(H��)/ c(HSO3-)��С����2������NaOH��Һ�������Ϊ2��3��H2SO3��Һ��������Һ����Ҫ����ΪNaHSO3��Na2SO3�������غ�Ϊ��c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0��1 mol/L ��HSO3�ĵ���̶ȴ���ˮ��̶ȣ�����Һ�����ԣ�Ũ�ȹ�ϵΪc(Na+)��c(SO32-)��c(HSO3-)��c(H+)��c(OH-)����3�����ݵ���غ� c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),��Һ��������c(H+)= c(OH-)������c(Na+)+ =2c(SO32-)+c(HSO3-),��c(Na��) ��2c(SO32��)���� 4 )���ݵ���غ�c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH��6������c(H+)=10-6 mol/L�� c(OH-)=10-8 mol/L��2c(SO32��) ��c(HSO3-)��c(Na��)��c(H+)-c(OH-)=10-6-10-8
H++ HSO3-������NaHSO3����ʹ��c(HSO3-)��������c(H��)/ c(HSO3-)��С����2������NaOH��Һ�������Ϊ2��3��H2SO3��Һ��������Һ����Ҫ����ΪNaHSO3��Na2SO3�������غ�Ϊ��c(Na+)+c(SO32-)+c(HSO3-)+c(H2SO3) =0��1 mol/L ��HSO3�ĵ���̶ȴ���ˮ��̶ȣ�����Һ�����ԣ�Ũ�ȹ�ϵΪc(Na+)��c(SO32-)��c(HSO3-)��c(H+)��c(OH-)����3�����ݵ���غ� c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),��Һ��������c(H+)= c(OH-)������c(Na+)+ =2c(SO32-)+c(HSO3-),��c(Na��) ��2c(SO32��)���� 4 )���ݵ���غ�c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-), pH��6������c(H+)=10-6 mol/L�� c(OH-)=10-8 mol/L��2c(SO32��) ��c(HSO3-)��c(Na��)��c(H+)-c(OH-)=10-6-10-8
���㣺ˮ��ƽ�������Ũ��С��С�Ƚϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡӢ��ѧУ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������CuO��MgO��ĩ�ֱ�����ͬ�������������ȫ�ܽ⣬�õ���Cu(NO3)2��Mg(NO3)2��Һ��Ũ�ȷֱ�Ϊa mol/L��b mol/L����a��b�Ĺ�ϵΪ
A��a��b B��2a��b C��a��2b D��a��5b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ������
(14��)ij��Һ�п��ܺ�Mg2+��Al3+��Fe3+��Cu2+��NH4+��K+�еļ������ӡ�����������Ĺ�������ʱ������ɫ��ζ�����������ͬʱ���ɰ�ɫ����������Ĺ������Ƶ����������������֮��Ĺ�ϵ��ͼ��ʾ���Իش�
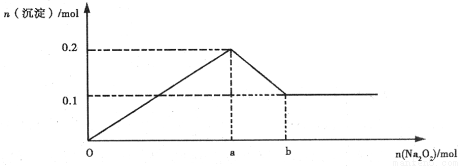
��1������Һ��һ���� ���ӣ�һ��û�� ���ӡ�
��2����ȷ���Ƿ��� ���ӡ�Ҫȷ���Ƿ���ڸ����ӣ������� ʵ�飬���ڸ����ӵ�ʵ������Ϊ ��
��3���߶�oa��ab=
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ײ��ϡ�������ֱ��Ϊ1��100nm�IJ��ϣ�����̼�������е�һ�֣���������̼���ȵط�ɢ������ˮ�У����γɵ�����
�٣�����Һ �ڣ��ǽ��� �ۣ��ܲ��������ЧӦ �ܣ�������ֽ
�ݣ���������ֽ �ޣ����ú�������ɫ����
A���٢ܢ� ��.�ڢۢ� �ã��ڢۢ� ��.�٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ë��պȡ����30% FeCl3��Һ��ͭƬ�ϻ�һ����Cu���֣�����Ƭ�̣�������ˮ��ͭƬ�ϵ���Һ�嵽С�ձ��У�����˵����ȷ����
A���ձ��е���Һ���ػ�ɫ B��ͭƬ���κα仯
C��ͭƬ���а��ݵġ�Cu���� D�������˷�Ӧ��Fe3++Cu=Cu2++Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������װ���У�MSO4��NSO4�����ֳ��������������Ρ���K�պ�ʱ��SO42�����ҵ���ͨ������Ĥ����M�������з�����ȷ����

A����Һ��c(M2��)��С
B��N�ĵ缫��Ӧʽ��N===N2����2e��
C��X�缫����H2������������ԭ��Ӧ
D����Ӧ������Y�缫��Χ���ɰ�ɫ��״����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ���й����ʵ���Ũ�ȹ�ϵ����ȷ��
A��pH��2��HA��Һ��pH��12��MOH��Һ������Ȼ�ϣ�c(H��)��c(M��)��c(OH��)��c(A��)
B��pH��ȵ�CH3COONa��NaOH��Na2CO3������Һ��c(NaOH)��c(CH3COONa)��c(Na2CO3)
C�����ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�c(CH3COO��)��2c(OH��)��2c(H��)��c(CH3COOH)
D��0��1 mol��L��1��NaHA��Һ����pH��4��c(HA��)��c(H��)��c(A2��)��c(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��ˮ�и�һ��ѧ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�������ڷ�Ӧ��ֻ������ԭ�����ǽ����ڷ�Ӧ��ֻ����������
B���������ڷ�Ӧ��ʧȥ���ӣ���ԭ���ڷ�Ӧ�еõ�����
C�����������������ԣ���ԭ�����л�ԭ��
D��������ֻ�������ԣ�������ֻ�л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�߶���ѧ��1��������⻯ѧ�Ծ��������棩 ���ͣ������
��18�֣���֪25 ��ʱ����������ʵĵ���ƽ�ⳣ���������±���
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10��1 | 1.7��10��5 | 6.2��10��10 | K1��4.3��10��7 K2��5.6��10��11 |
�ش��������⣺
��1��д��̼��ĵ�һ������ƽ�ⳣ������ʽ��K1��_______________________��
��2�������ʵ���Ũ�ȵ�a.CH3COONa��b.NaCN��c.Na2CO3��d.NaHCO3��Һ��pH�ɴ�С��˳��Ϊ___ _____(����ĸ)��
��3�������£�0.1 mol��L��1��CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ����� (�����)
A��[H��] B��[H��]/[CH3COOH] C��[H��]��[OH��] D��[OH��]/[H��]
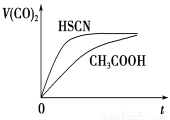
��4��25 ��ʱ����20 mL 0.1 mol��L��1 CH3COOH��Һ��20mL0.1 mol��L ��1HSCN��Һ�ֱ���20 mL 0.1 mol��L��1NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ����Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���� ��Ӧ��������������Һ�У�c(CH3COO��)________c(SCN��)(�����������������)
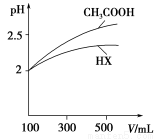
��5�������Ϊ100 mL pH��2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��________(����ڡ�����С�ڡ����ڡ�)CH3COOH�ĵ���ƽ�ⳣ����
��6��25 ��ʱ����CH3COOH��CH3COONa�Ļ����Һ�У������pH��6������Һ��c(CH3COO��)��c(Na��)��________mol��L��1(�ȷֵ)��
c(CH3COO��)/c(CH3COOH)��________��
��7��д������CO2ͨ�����������Һ�е����ӷ���ʽ��_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com