
| A. | 一定温度下,pH=6的纯水中含有OH-的数目为10-6NA | |
| B. | 120g NaHSO4固体中含有的离子总数为2NA | |
| C. | 标准状况下,22.4L乙烷中所含分子的数目为NA | |
| D. | 100mL 0.5mol/L-1的(NH4)2SO4溶液中,NH4+的数目为0.1NA |
分析 A.一定温度离子积常为10-12,计算氢氧根离子浓度为10-6mol/L,溶液体积不知不能计算微粒数;
B.硫酸氢钠是钠离子和硫酸氢根离子构成;
C.标况下22.4L乙烷的物质的量为1mol;
D.氨根离子为弱碱阳离子,部分发生水解.
解答 解:A.一定温度下,pH=6的纯水中,离子积常为10-12,氢氧根离子浓度为10-6mol/L,溶液体积不知不能计算氢氧根微粒数,故A错误;
B.120g NaHSO4固体的物质的量为$\frac{120g}{120g/mol}$=1mol,含有的离子总数为2NA,故B正确;
C.标准状况下,22.4L乙烷的物质的量为1mol,乙烷含有的分子数为NA,故C正确;
D.氨根离子为弱碱阳离子,部分发生水解,所以100mL 0.5mol/L-1的(NH4)2SO4溶液中,NH4+的数目小于0.1NA,故D错误;
故选:BC.
点评 本题考查了阿伏伽德罗常数的应用,掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系,注意盐类的水解规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 10:11:9 | C. | 10:11:8 | D. | 11:9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol | B. | 0.25 mol | C. | 0.5 mol | D. | 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
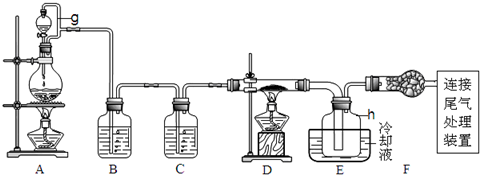
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量酸性高锰酸钾溶液和过量草酸(H2C2O4)溶液混合,分成三等份,分别置于不同的温度下,观察比较溶液颜色变化的快慢以探究温度对反应速率的影响 | |
| B. | 可用酒精萃取溴水,将分液漏斗振摇几次后需要从分液漏斗上口放气 | |
| C. | 标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 | |
| D. | 用镊子夹取金属钠固体,切割取用后剩余的钠不能放回原试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com