
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ | |
| C. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 硫化钠溶液显碱性:S2-+2H2O?H2S+2OH- |
分析 A.不符合反应客观事实;
B.漏掉镁离子与氢氧根离子的反应;
C.氢氧化钙少量,反应生成碳酸钙和碳酸钠、水;
D.硫离子为多元弱酸根离子,分步水解,以第一步为主.
解答 解:A.氯化铝溶液中加入过量氨水反应生成氢氧化铝沉淀和氯化铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.MgSO4溶液中加入Ba(OH)2溶液,离子方程式:Mg2++2OH-+SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故B错误;
C.NaHCO3溶液加入少量Ca(OH)2溶液,离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故C正确;
D.硫化钠溶液显碱性,离子方程式:S2-+H2O?HS-+OH-,故D错误;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实,遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:推断题
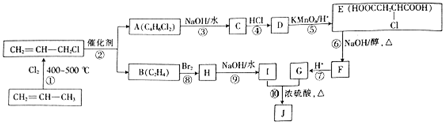
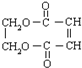 .
.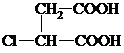 +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
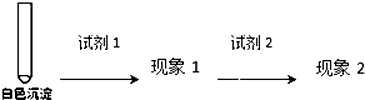
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com