
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
分析 A.NaOH滴定盐酸,选用酚酞作指示剂,开始为无色,滴定终点显碱性,则溶液变为红色;
B.盐酸体积20.00mL,而量筒的感量为0.1mL;
B.滴定管尖嘴悬有一滴液体,消耗V(NaOH)偏大,c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$;
D.结合c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$计算.
解答 解:A.NaOH滴定盐酸,选用酚酞作指示剂,终点时,溶液由无色变为红色、且30s不变色,故A错误;
B.盐酸体积20.00mL,而量筒的感量为0.1mL,不能使用量筒,可选碱式滴定管或移液管量取,故B错误;
B.滴定管尖嘴悬有一滴液体,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,所测的盐酸浓度偏大,故C正确;
D.用 0.50mol•L-1NaOH标准液10.00mL,滴定未知浓度的盐酸20.00mL,则c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$=$\frac{0.01L×0.50mol/L}{0.02L}$=0.25mol/L,故D错误;
故选C.
点评 本题考查中和滴定,为高频考点,把握指示剂选择、仪器使用、滴定原理为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O属于碱性氧化物 | |
| B. | Na2CO3长期暴露在空气中变为NaHCO3 | |
| C. | NaOH溶液保存在带玻璃塞的玻璃瓶中 | |
| D. | 向NaHCO3溶液中滴加稀盐酸,开始时无想象,一段时间后有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
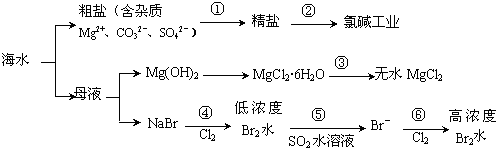
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| B. | AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 | |
| C. | 室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗、烧杯、蒸发皿、酒精灯 | B. | 量筒、烧杯、试管夹、蒸发皿 | ||
| C. | 玻璃棒、蒸发皿、漏斗、集气瓶 | D. | 铁架台、天平、长颈漏斗、酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
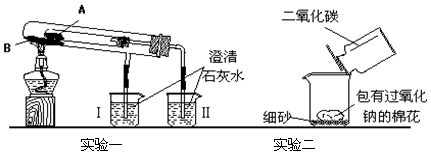
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol HCl溶于1 L水中得到的溶液 | |
| B. | 将1 mol SO3溶于1 L水中得到的溶液 | |
| C. | 将1 mol H2SO4溶于水制成的体积1 L的溶液 | |
| D. | 将0.5 mol SO3溶于水制成的体积1 L的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com